-
SO2是硫元素重要的化合物,是大气主要污染物之一,是形成酸雨的主要原因,是以还原性为主的酸性氧化物,具有漂白性。
Ⅰ.检验SO2气体的实验方法和现象是______________。
Ⅱ.探究SO2气体的氧化性和还原性,可以使用的药品和装置如图1所示:
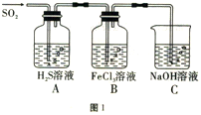
(1) 装置A中的现象是______,写出B中发生反应的离子方程式:______。
(2) 在上述装置中通入过量的SO2,为了验证B中SO2与Fe3+发生了氧化还原反应,取B中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_________,原因是__________。
Ⅲ.使用如图2所示的装置进行实验,探究SO2与Na2O2的反应(图中铁架台等装置已略去)。
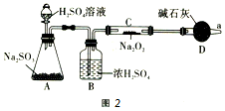
假设1 : 2SO2+2Na2O2=2Na2SO3+O2
假设2 : SO2+ Na2O2=2Na2SO4
(1) D装置的作用是______________。
(2)为验证假设1正确,需要进行的实验操作和现象是______________。
(3)为验证假设2正确,需要进行的实验操作和现象是______________。
-
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案:
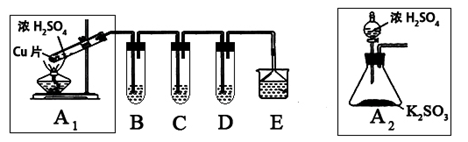
(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体___________________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:______________________________________________ ___________________________________________________ | _________________________ |
-
煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
N2(g) + O2(g)  2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g) 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________
②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
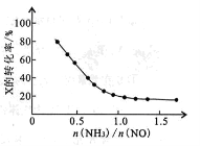
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3 NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2 2NO2; SO2+ O3
2NO2; SO2+ O3 SO3 + O2
SO3 + O2
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
-
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有________。
(2) 可用尿素
可用尿素 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: 。当消耗掉12g尿素时,转移电子的物质的量是________。
。当消耗掉12g尿素时,转移电子的物质的量是________。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有:

则反应 ________KJ/mol
________KJ/mol
(4)CO可用于合成甲醇,反应方程式为 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
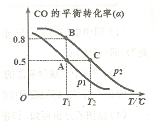
则该反应是 ________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为________L。
________0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为________L。
(5)工业上用氨水将来 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为________;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为________;已知25℃时,0.05mol/L(NH4)2SO4溶液的 ,则
,则 =________(用含a的代数式表示,已知
=________(用含a的代数式表示,已知 的电离常数
的电离常数 )。
)。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
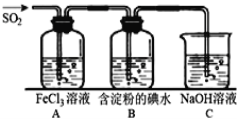
(1)写出由铜和浓硫酸制取SO2的化学方程式_______________________________。
(2)装置A中的现象是__________________________________________________。反应结束后若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在蒸发操作中要用到的主要仪器有_______(填编号)。自然干燥晶体而不烘干晶体的原因是___________________________。
A.酒精灯 B.蒸发皿 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式__________________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明SO2的还原性比I-_________(填“强”或“弱”)。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
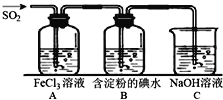
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。
-
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:
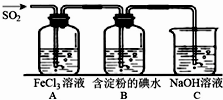
(1)写出由铜和浓硫酸制取SO2的化学方程式_____________________。
(2)装置A中的现象是__________。若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在过滤操作中有用到的玻璃仪器有_______(填编号)。
A酒精灯 B烧瓶 C漏斗 D烧杯 E玻璃棒 F坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式___________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明I-的还原性比SO2__________(填“强”或“弱”)。
(5)若C中所得溶液只有一种溶质且pH>7,则溶液中各离子浓度大小顺序为_________。
(6)工业上通过煅烧黄铁矿产生SO2来进一步得到硫酸,已知煅烧1g FeS2产生7.1kJ热量,写出煅烧FeS2的热化学反应方程式____________________。
-
[2012·广东肇庆市一模](14分)I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
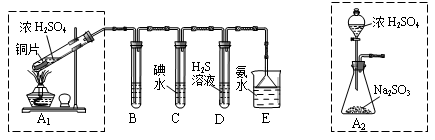
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为________;
C中反应的离子方程式为________。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是________(写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为________。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________ ________。 | ________ ________。 |
| 步骤3:________ ________。 | ________ ________。 |
-
(10分)SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
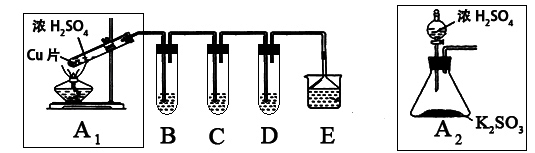
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵ 为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
-
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:

⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
| 步骤3____________________________________________ | _________________________ |











