-
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ/mol。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1 )判断该反应达到平衡状态的标志是___________(填字母)。
A.SO2、O2、SO3三者的浓度之比为2∶1∶2 B.容器内气体的压强不变
C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化
E.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率=_______________;②达到平衡时反应放出的热量为____________kJ;③此温度下该反应的平衡常数K=__________。
(3)右图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1________T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA_________KB,KA_________KD。
-
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)'ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g)'ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的 。请回答下列问题:
。请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母序号)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为________;
②达到平衡时反应放出的热量为________;
③此温度下该反应的平衡常数K=________。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1________T2(填“>”“<”或“=”,下同);
②平衡常数关系:KA ________KB,KA________KD。
-
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是____________(填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为_____________________ ;
②达到平衡时反应放出的热量为 _________________ ;
③此温度下该反应的平衡常数K=___________________ 。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:

①温度关系:T1_______________ T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA____________ KB, KA__________ KD。
-
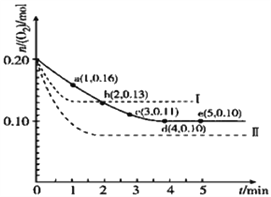
一定温度下,在2L的密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
2SO3(g)△H<0,n(O2)随时间的变化关系如图实线所示:
(1)该温度下反应的平衡常数K为_______________(不用带单位),升高温度K值将_______________(填增大、不变或减小,下同)。
(2)若温度不变,在容器中再加1mol O2,重新达到平衡,则SO2的平衡浓度将_______________,氧气的转化率将_______________,SO3的体积分数将_______________。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线Ⅰ改变的实验条件是_______________,曲线Ⅱ改变的实验条件是_______________。
-
(12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
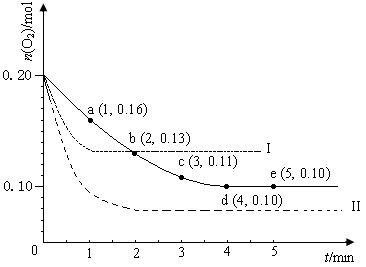
(1)用SO2表示0~4 min内该反应的平均速率为________。该温度下反应的平衡常数K为________。升高温度K值 ________ (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度________
(填“增大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”),SO3的体积分数________(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
-
(12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:

(1)用SO2表示0~4 min内该反应的平均速率为________。该温度下反应的平衡常数K为________。升高温度K值 ________ (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度________
(填“增大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”),SO3的体积分数________(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
-
(12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
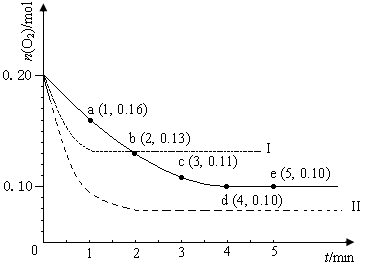
(1)用SO2表示0~4 min内该反应的平均速率为________。该温度下反应的平衡常数K为________。升高温度K值 ________ (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度________
(填“增大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”),SO3的体积分数________(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
-
(12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:

(1)用SO2表示0~4 min内该反应的平均速率为________。该温度下反应的平衡常数K为________。升高温度K值 ________ (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度________
(填“增大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”),SO3的体积分数________(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
-
在一定条件下发生反应2SO3(g) 2SO2(g)+ O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。 则下列说法正确的是()
2SO2(g)+ O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。 则下列说法正确的是()
A. 0〜5 min,O2的生成速率 v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了 0.25 molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
-
在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2  2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
A. 等于1.6 mol B. 等于1.2 mol
C. 小于1.2 mol D. 大于1.6 mol







