-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2 和 O2,Cl2O 易溶于水并与水反应生成 HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比 1∶3 混合通入含水 8%的碳酸钠中制备 Cl2O,并 用水吸收 Cl2O(不含 Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为 → → →C→ 。_____
(2)写出 A 中反应的离子方程式______。
(3)装置 B 中多孔球泡和搅拌棒的作用是_________; 装置 C 的作用是_____。
(4)制备 Cl2O 的化学方程式为_____。
(5)反应过程中,装置 B 需放在冷水中,其目的是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_____、_____。
(测定浓度)
(7)用下列实验方案测定装置 E 所得溶液中次氯酸的物质的量浓度:
量取 10.00 mL 上述次氯酸溶液,并稀释至 100.00 mL,再从其中取出 10.00 mL 于 锥形瓶中,并加入 10.00 mL 0.8000 mol·L-1 的 FeSO4 溶液(过量),充分反应后,用0.05000 mol·L-1 的酸性 KMnO4 溶液滴定剩余的 Fe2+,消耗 KMnO4 溶液 24.00 mL,则 原次氯酸溶液的浓度为_____。判断下列情况对 HClO 含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若 FeSO4 标准溶液部分变质,会使测定结果_____;若配制酸性 KMnO4 溶液 时,定容时俯视刻度线,会使测定结果_________。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
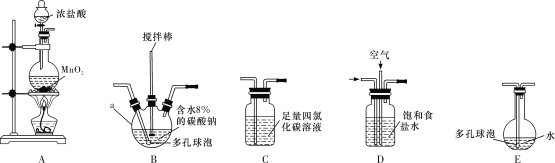
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
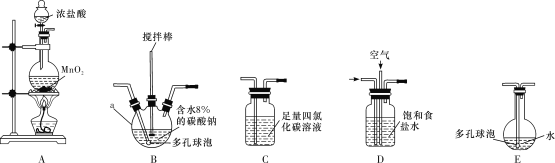
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
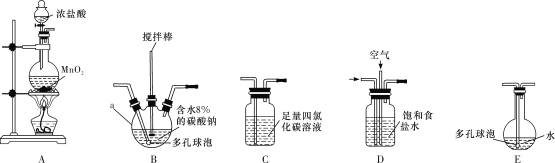
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
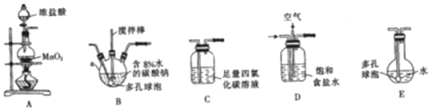
(1)各装置的连接顺序为______→ → →C→ 。
(2)装置B中多孔球泡和搅拌棒的作用是____________________________________ ;装置C的作用是_____________________。
(3)制备Cl2O的化学方程式为________________________。
(4)反应过程中,装置B需放在冷水中,其目的是_____________________________。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是_______。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
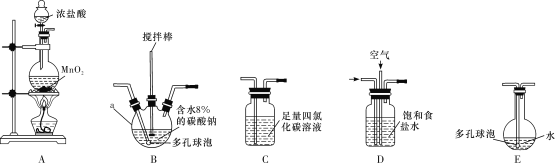
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
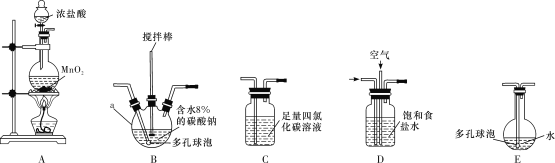
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
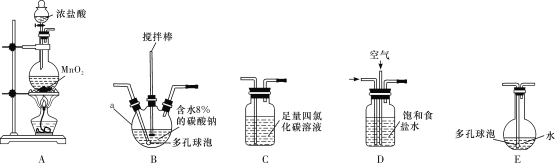
(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃ 以上会分解生成C12和O2,Cl2O易溶于水并与水反应生成HClO。
【制备产品】
甲组同学拟将氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
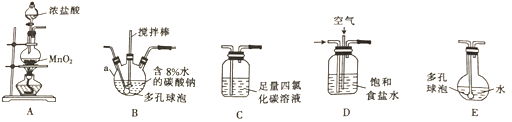
(1)仪器a 的名称是_________.
(2)各装置的连接顺序为______→ → → → 。
(3)装置B中多孔球泡和搅拌棒的作用是___________。
(4)制备Cl2O的化学方程式为____________。
(5)反应过程中,装置B需放在冷水中,其目的是__________。
(6)装置E中生成的HClO见光易分解,宜采用_________(填颜色)平底烧瓶,装置C的作用是__________。
【测定浓度】
(7)已知次氯酸可被KI、FeSO4等物质还原出Cl-。乙组同学设计实验方案测定装置E中所得溶液中HClO的物质的量浓度,请补充完整实验方案:用酸式滴定管量取一定体积的次氯酸溶液于锥形瓶中,_______,(所提供试剂:淀粉KI溶液、0.10mol·L-1的FeSO4溶液、0.10mol·L-1的KmnO4酸性溶液)
-
常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃ 以上会分解生成C12和O2,Cl2O易溶于水并与水反应生成HClO。
【制备产品】
甲组同学拟将氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。
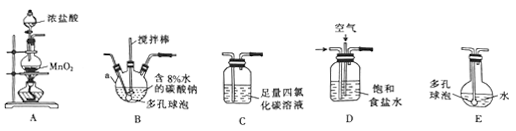
(1)仪器a 的名称是_________.
(2)各装置的连接顺序为______→ → → → 。
(3)装置B中多孔球泡和搅拌棒的作用是___________。
(4)制备Cl2O的化学方程式为____________。
(5)反应过程中,装置B需放在冷水中,其目的是__________。
(6)装置E中生成的HClO见光易分解,宜采用_________(填颜色)平底烧瓶,装置C的作用是__________。
【测定浓度】
(7)已知次氯酸可被KI、FeSO4等物质还原出Cl-。乙组同学设计实验方案测定装置E中所得溶液中HClO的物质的量浓度,请补充完整实验方案:用酸式滴定管量取一定体积的次氯酸溶液于锥形瓶中,_______,(所提供试剂:淀粉KI溶液、0.10mol·L-1的FeSO4溶液、0.10mol·L-1的KmnO4酸性溶液)









