-
某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
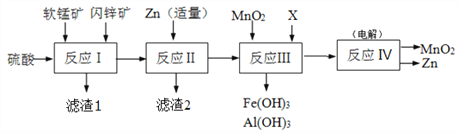
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10−15]
-
某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
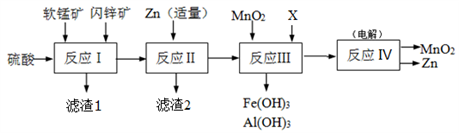
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10−15]
-
某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
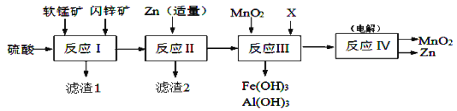
已知:反应Ⅰ中所有金属元素均以离子形式存在。有关常数:Ksp[Al(OH)3]=1.0×10-33、Ksp[Fe(OH)3]=3.0×10-39、Ksp[Mn(OH)2]=2.0×10-13、Ksp[Zn(OH)2]=1.0×10-17、Ksp(MnCO3)=2.0×10-11、Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式____________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是___________。
(3)反应Ⅲ中MnO2的作用是_______________________,若反应后溶液中Mn2+、Zn2+均为0.1mol·L-1,需调节溶液pH范围为_______________(溶液中,当一种离子的浓度小于10-6mol/L时可认为已不存在),X可以是_________。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式________________________。本工艺可以循环利用的物质有MnO2、Zn和_________。
(5)MnCO3有多种用途。废水处理领域中常用NH4HCO3溶液将Mn2+转化为MnCO3,该反应的离子方程式为______。试通过题述有关数据简要计算说明该反应能进行的原因:____________________________。
-
某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:

已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×10−7,K2=7.0×10−15。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L−1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS−浓度为1.0×10−4 mol·L−1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×10−15]
-
软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
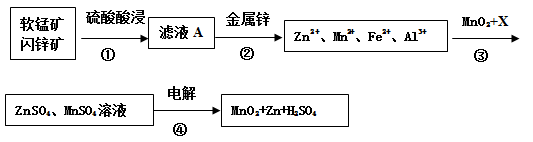
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]
-
某地有软锰矿(主要成分 MnO2,含少量 SiO2 和 Al2O3)和闪锌矿(主要成分 ZnS,含少量 FeS、CuS 和 CdS)两座矿山。综合利用的工艺如下,主产品是通过电解获得的锌和二氧化锰,副产品为硫磺、少量金属铜和镉。生产中除矿石外,只需购入少量的硫酸和纯碱。
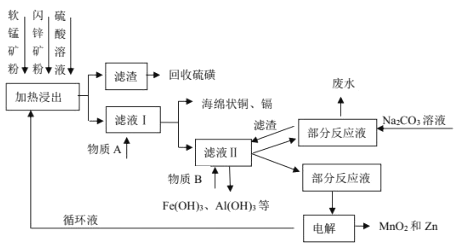
(1)以 FeS 为例,写出生成硫磺的反应方程式____。
(2)回收的硫磺可用于制取石硫合剂:在反应器内加水使石灰消解,然后加足量水,在搅拌下把硫磺粉慢慢倒入,升温熬煮,使硫发生歧化反应,先得到白色浑浊液,进一步反应得粘稠状深棕色液体,并残留少量固体杂质。制备中先得到的白色浑浊物是________________,残留的固体杂质可能是_________________。
(3)写出物质 A 和 B的化学式_____、_____。
(4)不在滤液Ⅱ中直接加入 Na2CO3 的原因是_____。
(5)电解时的阴极材料为_____,阳极的电极反应式为_______________。
(6)已知 H2CO3 的 Ka1=4×10-7,Ka2=5×10-11,则浓度均为 0.5mol/L 的 Na2CO3 和 NaHCO3 的混合溶液的 pH 约为___________(lg4=0.6,lg5=0.7),溶液中含碳微粒的浓度从大到小的顺序为_____向此溶液中不断滴加 1mol/L 稀 HCl 时,溶液中 c(CO32-)的变化曲线如下图所示,请在图中画出溶液中其它含碳微粒浓度变化的曲线。_________________________

-
工业上主要采用软锰矿和闪锌矿联合生产MnO2和锌。软锰矿主要成分为MnO2,还含少量A12O3和SiO2杂质。闪锌矿主要成分为ZnS,还含少量FeS、CuS杂质。现用稍过量的软猛矿和闪转矿为原料,经过一系列处理后制备产品“MnO2和锌”。工艺流程如下:
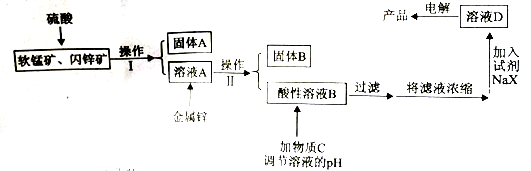
已知:I:金属硫化物、硫酸、二氧化锰三者发生的反应均是氧化还原反应。
例如: MnO2+ZnS+2H2SO4 MnSO4+ZnSO4+S+2H2O。
MnSO4+ZnSO4+S+2H2O。
II:4X-+Mn2+ MnX42-,X-不参与电极反应。Zn2+与X-不反应。
MnX42-,X-不参与电极反应。Zn2+与X-不反应。
III:各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)操作I的名称是_____________。
(2)物质C是MnO2和ZnO的混合物。加入物质C充分作用后,过滤,所得固体的成分是_______(用化学式表示)。
(3)电解溶液D的装置如下图所示,两个电极都是惰性电极。
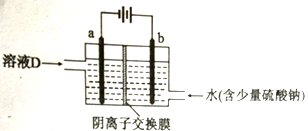
①硫酸钠的作用是__________________。
②b电极的电极反应式是____________________________________。
请用平衡移动原理解释加入试剂NaX的作用:___________________________。
(4)若一定质量的闪锌矿中含1.76kg FeS,则在上述流程中1.76kg FeS消粍MnO2的质量为_____kg。
(5)现有0.4mol/LMn(NO3)2、0.8mol/LZn(NO3)2的混合溶液100mL,向该混合液中逐滴加入Na2S溶液,当MnS沉淀一定程度时,测得c( Mn2+) = 2.0×10-3mol/L,则此时c(Zn2+)=______[已知Ksp(ZnS) =1.3×10-24,Ksp(MnS) =2.6×10-13]。
-
闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。软锰矿的主要成分为 MnO2;含少量A12O3和SiO2。现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如下(中间产物的固体部分已经略去)。
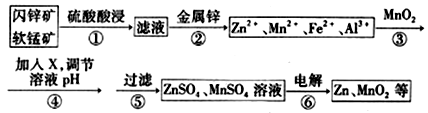
已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式________________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_______________。
(3)步骤③与MnO2发生氧化还原反应的离子方程式_________________,物质X可以是__________(用字母表示。
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是____________(填化学式)。
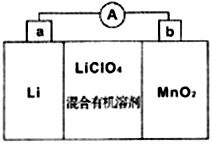
(5)MnO2与Li构成LiMnO2,该电池反应原理如右图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
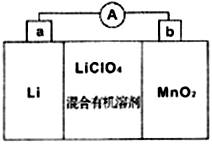
①外电路中的电子移动方向是由______极流向______极(填字母)。
②写出该锂离子电池的正极电极反应式_____________________________。
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7 ,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为______________________。
-
闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。软锰矿的主要成分为 MnO2;含少量A12O3和SiO2。现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如下(中间产物的固体部分已经略去)。
已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式________________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_______________。
(3)步骤③与MnO2发生氧化还原反应的离子方程式_________________,物质X可以是__________(用字母表示。
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是____________(填化学式)。
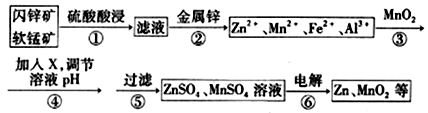
(5)MnO2与Li构成LiMnO2,该电池反应原理如右图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
①外电路中的电子移动方向是由______极流向______极(填字母)。
②写出该锂离子电池的正极电极反应式_____________________________。
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7 ,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为______________________。
-
某工厂用软锰矿(主要为MnO2,含杂质Al2O3和闪锌矿(主要为ZnS,含杂质FeS) 共同生产干电池的原料Zn和MnO2,同时获得一些副产品,工艺流程如下:

已知:硫酸浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3 •
(1)“浸取”时发生的反应中,还原产物为_______________ (填化学式)。
(2)①“净化除杂”时,加入的物质X可能为______________(填选项字母)。
A.MnCO3 B. Zn2(OH)2CO3 C.NaOH D. KOH
②相关离子开始沉淀和完全沉淀的pH如下表所示,加入X后,溶液pH应调整到________。
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.3 | 3.2 |
| A13+ | 4.2 | 5.4 |
| Zn2+ | 7.2 | 8.0 |
| Mn2+ | 8.3 | 9.8 |
(3)只用一种试剂,即可从 “灼烧”所得的Fe2O3和Al2O3混合物中分离得到Fe2O3。该反应
的离子方程式为____________________________________。
(4)“电解”时,发生反应的化学方程式为____________________________________。
(5)从Na2SO4溶液中得到芒硝晶体(Na2SO4 • 10H2O),需要进行的实验操作有______、_____、过滤、洗涤、干燥等.
(6)Zn和MnO2的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为________________________________。
(7)用生产的Zn和MnO2制成干电池,在碱性条件下工作时有MnOOH生成,则该电池正极的电极反应式为________________________________。













