-
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式是 。又已知:H2O(l)=H2O(g) △H=-44kJ/mol,则11.2升(标准状况下)乙硼完全燃烧时生成气态水时放出的热量为 。
-
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为 ;
又知H2O(l)=H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 kJ
(2)发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知: ①N2(气)+2O2(气)=2NO2(气) △H=+67.7kJ/mol ②N2H4(气)+O2(气)=N2(气)+2H2O(气) △H=-534kJ/mol 试写出肼与NO2反应的热化学方程式:
(3)甲烷燃料电池:碱性电解质(铂为两极、电解液KOH溶液)
正极:___________ _____
负极:__________
总反应方程式: CH4+ 2O2 + 2OH- = CO32- + 3H2O
-
根据事实,写出298K时下列反应的热化学方程式:
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为__。
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量。___。
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___。
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ。__。
-
(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量649.5 中kJ,则表示乙硼烷燃烧热的热化学方程为 .
又已知:H2O(l)═H2O(g);△H=+44.0kJ/mol.则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量为 .
(2)恒温、恒压(1.01×105Pa)下,将2.0molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g);△H<0,T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a= .
-
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为______________。
(2)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。某化学过程如图所示,
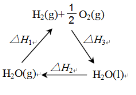
ΔH1、ΔH2、ΔH3三者之间的关系式为___________。
-
0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。
(1)写出反应的热化学方程式。
(2)已知H2O(l)转化为H2O(g)的△H=44kJ·mol-1,试计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量。
-
(1)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 |
| c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 |
| 时间/s | 3 | 4 | 5 |
| c(NO)/ mol·L-1 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01 mol/L,则此时反应处于____状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10 mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
① KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
② 清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
③ 滴定过程中发现一段时间后反应速率明显加快,除去温度的影响,你认为最有可能的原因是____。
-
(10分)(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出热量649.5 中kJ,其热化学方程为 。
又已知:H2O(l)=H2O(g);ΔH=+44.0kJ/mol。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量为 。
恒温、恒压(1.01×105Pa)下,将2.0molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(2)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a=__________;平衡时SO2的转化率为_________。T2℃下反应达平衡时,混合气体的物质的量共为4.8mol.T1与T2的关系是________(选填序号)。
①T1>T2 ②T1<T2 ③T1=T2
-
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为 。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(2)已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。
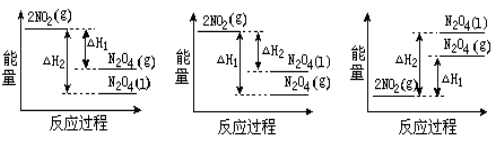
A B C
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 ;
-
(5分)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,表示乙硼烷燃烧热的热化学方程式为________________________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
N2O4(g) ΔH1 2NO2(g)
N2O4(l) ΔH2

