-
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。
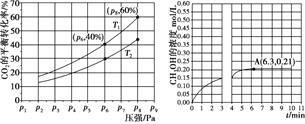
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
-
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2 加氢合成甲醇是合理利用 CO2 的有效途径。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅲ的 ΔS_____(填“<”、“=”或“>”)0;反应Ⅱ的 ΔH2=_____。
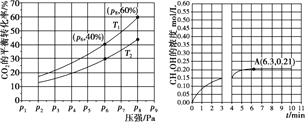
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图所示。
①比较T1与T2 的大小关系:T1_____T2 (填“ < ”、“= ”或“> ”) ,理由是:_____。
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为_____。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图所示(3~4 min 的浓度变化未表示出来),则改变的条件为_____,请用 H2 的浓度变化计算从4 min 开始到A点的反应速率v(H2)=_____(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_____L。
-
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+H2(g)  CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
反应Ⅱ:CO(g)+2H2(g)  CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应Ⅲ:CO2(g)+3H2g)  CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1
回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ的化学平衡常数分别为K1、K2、K3、则K3=__________(用K的代数式表示)
(2)在恒压密闭容器中,充入一定量的 H2 和 CO2(假定仅发生反应Ⅲ),实验测得反应物在不同温度下,反应体系中 CO2 的平衡转化率与压强的关系曲线如图 1 所示。
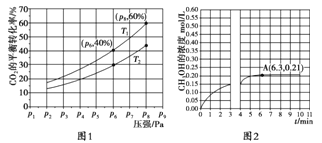
①比较 T1 与 T2 的大小关系:T1____________T2(填“<”、“=”或“>”)
②在 T1 和 p6 的条件下,往密闭容器中充入 3 mol H2 和 1 mol CO2,该反应在第 5 min 时达到平衡,此时容器的体积为 1.8 L,则该反应在此温度下的平衡常数为________。
a.若此条件下反应至 3 min 时刻,改变条件并于 A 点处达到平衡,CH3OH 的浓度随反应时间的变化趋势如图 2所示(3~4 min 的浓度变化未表示出来),则改变的条件为 __________,请用 H2 的浓度变化计算从4 min开始到 A点的反应速率v(H2)= _________(保留两位小数)。
b.若温度不变,压强恒定在 p8 的条件下重新达到平衡时,容器的体积变为_______L
-
近年来,由CO2催化加氢合成甲醇的相关研究受到越来越多的关注。该方法既可解决CO2废气的利用问题,又可开发生产甲醇的新途径,具有良好的应用前景。已知4.4 g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95 kJ的能量。
(1)该反应的热化学方程式为:__________________________________________.
(2)在270℃、8 MPa和适当催化剂的条件下,CO2的转化率达到22%,则4.48 m3(已折合为标准状况)的CO2在合成CH3OH气体过程中能放出热量________ kJ.
(3)又已知H2O(g)===H2O(l) ΔH=-44 kJ/mol,则CO2气体与H2气体反应生成CH3OH气体16g和液态水时放出热量为________kJ.
-
I.甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+H2(g) CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
CO(g)+H2O(g) △H2 =41 kJ·mol-1 回答下列问题:
| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
①已知反应①中的相关的化学键键能(“C O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
O”表示CO的化学键)数据见表:由此计算△H1=________ kJ·mol-1
②请写出CO2(g)和H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式:____________________该反应的平衡常数K3=_______________ 。 (反应①和反应②对应的平衡常数为K1和K2)
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。该电池负极的电极反应式为________________。
Ⅱ.在2L密闭容器中,800℃时反应2NO(g)+O2 (g) 2NO2 (g)体系中,n(NO)随时间的变化如表:
2NO2 (g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)如图所示表示NO2变化曲线的是____,用O2表示从0~2 s内该反应的平均速率v=_____。
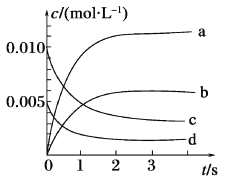
(4)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2) =2V(O2) b.容器内压强保持不变
c.体系颜色不再改变 d.容器内密度保持不变
-
CO2的固定和利用对降低温室气体排放具有重要作用,CO2加氢合成甲醇不仅可以有效缓解减排压力,而且还是CO2综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
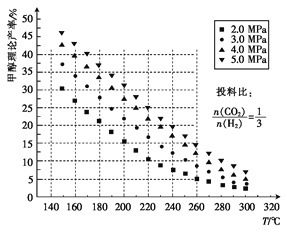
(1)下列措施能使CO2的转化率提高的是__。
A. 增大压强 B.升高温度 C.增大投料比 D.加入更高效的催化剂
(2)在220℃、5.0MPa时,CO2、H2的转化率之比为______。
(3)将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将___(填“增大”“减小”或“不变”,下同),CO2的转化率将____。
(4)200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K=___ 。
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A. 甲醇 B. 天然气 C. 液化石油气 D. 氢气
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A. 甲醇 B. 天然气 C. 氢气 D. 液化石油气
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气 C.液化石油气 D.氢气
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A.甲醇 B.天然气 C.氢气 D.液化石油气
CO(g)+H2O(g) ΔH1=+41.19 kJ·mol-1
CH3OH(g) ΔH2
CH3OH(g)+H2O(g) ΔH3=-49.58 kJ·mol-1




