-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ•mol-1
2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0kJ•mol-1
2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的△H=________kJ•mol-1.
SO3(g)+NO(g)的△H=________kJ•mol-1.
(2)一定条件下,将1molNO2与2molSO2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变 b.混合气体颜色保持不变 c.体系气体密度不变了
d.每消耗1mol SO3的同时生成1molNO2 e.SO2和NO的体积比保持不变
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________;NO2的转化率=________.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g).
CH3OH(g).
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为________反应.(填“放热”或“吸热”)
②该反应的焓变为△H,活化能为E,下列能量关系图(图1)合理的是________.
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH2OH浓度随时间的变化曲线.

-
(14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。

(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
①该电池工作时,OH-向 极移动(填“正”或“负”)。
②该电池正极的电极反应式为 。
-
(14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。

(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
-
(10分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____________。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH=_____________0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH=_____________0(填“>”或“<”)。

-
(6分)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
若测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
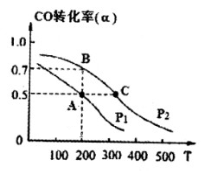
A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
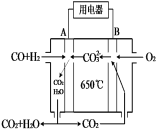
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=_______kJ·mol-1。
SO3(g)+NO(g)的ΔH=_______kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_________。(保留2位小数)
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。

该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___________________________________。
-
(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0kJ·mol-1
2NO2(g)ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.断裂3 mol H-H键的同时形成6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中的压强不随时间变化
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。
-
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=−196.6 kJ·mol–1
2SO3(g) ΔH=−196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=−113.0 kJ·mol–1
2NO2(g) ΔH=−113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
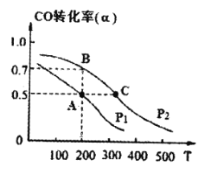

A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已 知:2SO2(g)+O2(g)
知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0kJ·mol-1
2NO2(g) ΔH=-113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
SO3(g)+NO(g)的ΔH=____________ kJ·mol-1。
(2)一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO3的同时生成1mol NO
若测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g
CH3OH(g )。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
)。CO在不同温度下的平衡转化率与压强的关系如图甲所示。该反应ΔH________0(填“>”或“<”)。
图甲: 图乙:
图乙:
(4)依据燃烧的反应原理,合成的甲醇可以设计如图乙所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”)。
②该电池正极的电极反应式为______________________。










 图乙:
图乙: