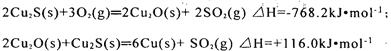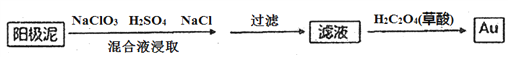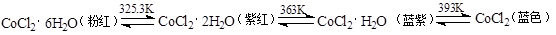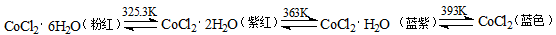-
金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJ•mol-1
②3Mn3O4(s)+ 8Al(s) =4A12O3(s) + 9Mn(s) △H2= bkJ•mol-1
已知A1的燃烧热为 ckJ•mol-1,则MnO2与A1发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq) Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化
B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变
D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=_________________,Mn2+的产率为____________。
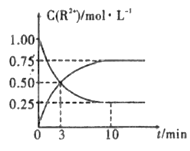
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
(4)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降。为了将Mn2+的浓度降到1.0×l0-9mol/L,则加入的Na2S溶液的浓度至少是____________mol/L [已知Ksp(MnS)=4.5×l0-14]。
-
金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJ•mol-1
②3Mn3O4(s)+ 8Al(s) =4A12O3(s) + 9Mn(s) △H2= bkJ•mol-1
已知A1的燃烧热为 ckJ•mol-1,则MnO2与A1发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq) Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化
B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变
D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=_________________,Mn2+的产率为____________。
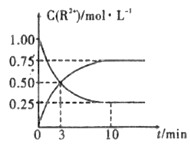
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
(4)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降。为了将Mn2+的浓度降到1.0×l0-9mol/L,则加入的Na2S溶液的浓度至少是____________mol/L [已知Ksp(MnS)=4.5×l0-14]。
-
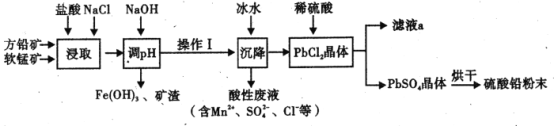
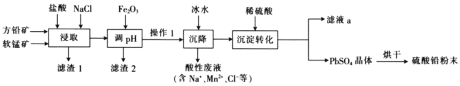
硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:
已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq )  PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g • L-1 ) 如图所示。下列叙述正确的是_____________(填字母)
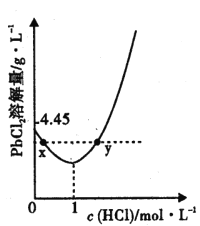
A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol• L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol• L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbO•PbSO4•H2O) ,写出该反应的化学方程式 _____________________.
-
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq) PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4) 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
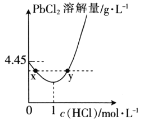
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
-
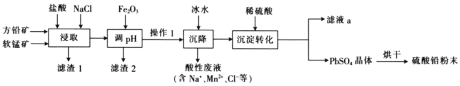
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq) PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4) 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
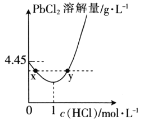
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
-
铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:

在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
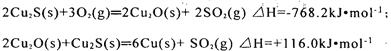
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:

下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
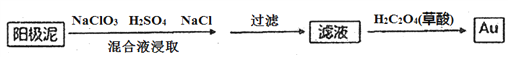
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
-
铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:
(1)基态Cu+原子核外电子排式为___。
(2)CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
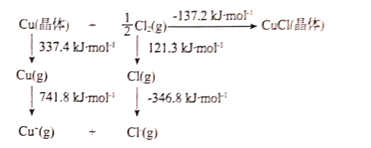
铜原子的第一电离能为___kJ•mol-1;Cl-Cl键键能为___kJ•mol-1;CuCl的晶格能为___kJ•mol-1。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
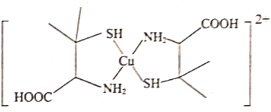
①青霉胺分子中S原子的轨道杂化类型为___;
②硫化氢与氨气键角的大小:H2S___NH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有___(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:___。
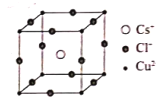
(4)某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:
①离子化合物M的化学式为___;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积___;
③若晶胞参数为anm,则这种晶体密度为___g•cm-3(用含a、和NA的式子表示)。
-
【化学——选修3:物质结构与性质】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。
请回答下列问题:
(1)Co基态原子的电子排布式为 ;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
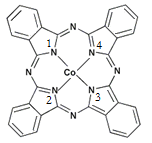
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
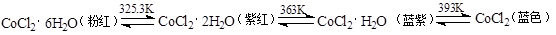
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用: ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式: ;
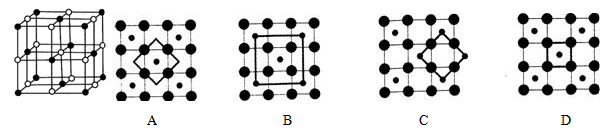
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成是 。
-
钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的电子排布式为 ;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
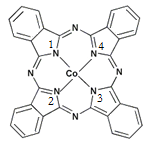
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
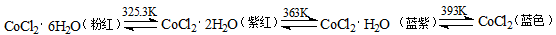
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用: ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过 量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式: ;
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。
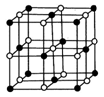
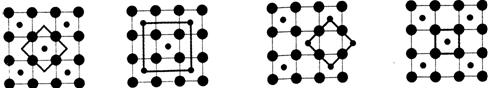
A. B. C. D.
-
铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
 基态Ni原子的价电子排布式为_______。镍与CO生成的配合物
基态Ni原子的价电子排布式为_______。镍与CO生成的配合物 ,
, 中含有的
中含有的 键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
 研究发现,在
研究发现,在 低压合成甲醇反应
低压合成甲醇反应 中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
 元素Co与O中,第一电离能较大的是_______。
元素Co与O中,第一电离能较大的是_______。
 生成物
生成物 与
与 中,沸点较高的是________,原因是___________。
中,沸点较高的是________,原因是___________。
 用KCN处理含
用KCN处理含 的盐溶液,有红色的
的盐溶液,有红色的 析出,将它溶于过量的KCN溶液后,可生成紫色的
析出,将它溶于过量的KCN溶液后,可生成紫色的 。
。 具有强还原性,在加热时能与水反应生成淡黄色的
具有强还原性,在加热时能与水反应生成淡黄色的 ,写出该反应的离子方程式____________。
,写出该反应的离子方程式____________。
 铁有
铁有 、
、 、
、 三种同素异形体
三种同素异形体 如图
如图 ,
, 、
、 两种晶胞中铁原子的配位数之比为_____。
两种晶胞中铁原子的配位数之比为_____。
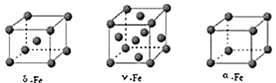
 若Fe原子半径为rpm,
若Fe原子半径为rpm, 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则 单质的密度为_______
单质的密度为_______ 列出算式即可
列出算式即可 。
。
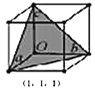
 在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为
在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为 1,
1, 晶面。如图,则
晶面。如图,则 晶胞体中
晶胞体中 1,
1, 晶面共有_____个。
晶面共有_____个。
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)