-
高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。
I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。
②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。
③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)补充完整步骤①:
(2)步骤③中H2C2O4·2H2O将过量的Cr2O72-还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:__________。
(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:_____________。
(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内 H2O2 的利用率随浓度的变化关系如图所示。5%的H2O2 比 20%的H2O2 的利用率低的原因是 _____________。

II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40 g SrO固体和10.16 g混合气体。计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)____________________。
-
玻璃可用于制造工艺品,下列物质能用于雕刻玻璃的是
A. 盐酸 B. 氢氟酸 C. 硫酸 D. 硝酸
-
(15分)氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g)  2NH3 (g) △H1
2NH3 (g) △H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l) △H2
③ N2 (g)+ O2 (g)= 2NO (g) △H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H=________;若不能,说明理由:
________。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应 |
| N2 | H2 | NH3 |
| a | 1 | 3 | 0 | 23.1 |
| b | 2 | 6 | 0 | 未知(用E表示) |
下列说法正确的是________(填序号)
① 反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)  2NH3(g) △H<0 。
2NH3(g) △H<0 。
氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:
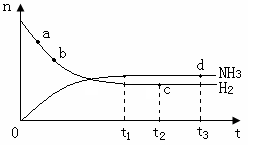
正反应速率最大的点是________(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是________(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 | c(CO2) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OCH3) /mol·L-1 | c(H2O) /mol·L-1 | v (正)和v (逆)比较 |
| 容器I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v (正)=v (逆) |
| 容器II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | |
容器I中的反应________(选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K=________。表格内的空格处v(正)与v(逆)的大小关系是________。
-
甘油是一种在医药、化妆品等方面应用广泛的保湿、保润剂,也是一种重要的工业原料,可用于合成环氧树脂、油脂、硝化甘油(三硝酸甘泊酯)等。由烷烃A合成甘油及其衍生物的一种路线如下图所示,请回答下列问题。
己如:①烷烃A的相对分子质量为44;B的核磁共振氢谱有两个峰。
②
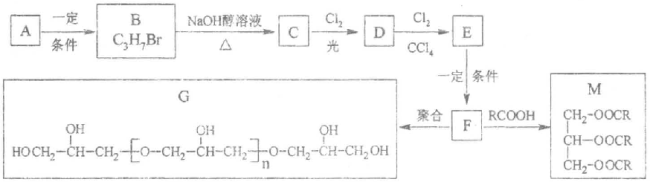
(1)A 的分子式(或化学式)为__________,F的官能团是____________。
(2)B→C的反应类型属于___________反应;F→G的反应类型属于_______(填“加聚”或“缩聚”)反应。
(3)B 的同分异构体的结构简式为_________,C与Cl2反应除生成D 外,另一无机产物为_______(写化学)。
(4)由D→E的化学方程式为:__________________。
(5)硝化甘油既是一种炸药,也是一种心绞痛急救药,它可由F 与硝酸制得。硝化甘油的结构简式为____________。
(6)1 mol M与足量的NaOH 洛液完全反应,至少消耗NaOH_______mol。
-
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
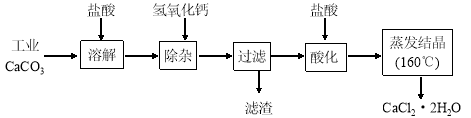
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________________ 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①步骤a中进行定容操作时视线应 ,直到 。
②上述测定过程中需用溶液润洗的仪器有__________________。
③计算上述样品中CaCl2·2H2O的质量分数为______________。
④若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),某同学认为偏高的原因可能是样品中存在少量的NaCl,要验证该同学的观点应进行的实验为 (填实验名称)。
-
对以下化学问题的解释中错误的是 ( )
A.工业盐酸显黄色,是由于含有杂质FeCl3
B.碘化钾溶液久置显黄色,是由于I被氧化,析出的I2溶于溶液中
C.浓硝酸显黄色,是由于硝酸见光分解生成的NO2溶液酸液中
D.炼钢是在高温下利用还原剂除去生铁中的杂质
-
下列有关物质用途的说法中正确的是
A.工业上利用氨气制硝酸属于人工固氮
B.在食品包装袋内放入生石灰可以防止食品因氧化而变质
C.氢氧化铝、碳酸镁、小苏打等可用于治疗胃酸过多
D.硅可用于制造光导纤维
-
镍的抗腐蚀性佳,主要用于合金和电镀,也可用作良好的催化剂。现准确称量8g粗镍(含有少量Fe、Cu以及难与酸、碱反应的杂质)进行如下提纯。

请回答下列问题:
(1)写出稀硝酸溶解镍的离子方程式___。
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节pH=5.5,继续加热煮沸5min,加热过程中补充适量的水保持溶液的体积不变,静止一段时间后,过滤出Fe2O3、FeO(OH)。
①写出煮沸过程中生成FeO(OH)的离子方程式___。
②控制溶液的pH,可利用___。
a.pH试纸 b.石蕊指示剂 c.pH计
③为了得到纯净的溶液B,还需要加入以下物质___(填字母)进行除杂。(已知:Ksp(CuS)=8.8×10-36;Ksp(NiS)=3.2×10-19;Ksp[Cu(OH)2]=2.2×10-20;Ksp[Ni(OH)2]=5.4×10-16)
a.NaOH b.Na2S C.H2S d.NH3·H2O
(3)在快速搅拌下缓慢向溶液B中滴加12%的H2C2O4溶液,溶液中即可析出NiC2O4·2H2O,搅拌下煮沸2min冷却。操作X包括:过滤、洗涤和烘干,采用如图的装置进行过滤(备注:该图是一个通过水泵减压过滤的装置)。这种抽滤其优点是___,装置B的主要作用是___,若实验过程中发现倒吸现象,应采取的措施是___。
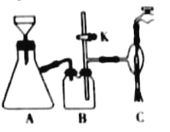
(4)在该生产过程中需要纯净的H2。若实验室要制备纯净的H2,发生装置不可以选择___(选填代号)。

(5)用电子天平称取0.5000g的NiO样品,加入一定体积的6mol/L的盐酸恰好完全溶解,将所得到的溶液配制成250mL的溶液。取出20mL加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为___。(写出表达式即可)
[一定条件下丁二酮肟(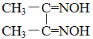 ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
-
下列说法中,正确的是( )
A.水晶和陶瓷的主要成分都属于硅酸盐
B.单质硅是制造光导纤维的材料
C.硅酸钠是制备硅胶和木材防火剂的原料
D.工业上用硝酸刻蚀玻璃
-
关于工业生产的叙述,错误的是 ( )。
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.制造普通水泥的主要原料是黏土、石灰石








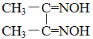 ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。