-
“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示:
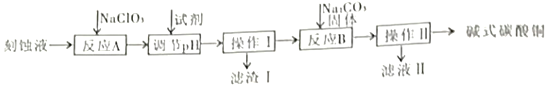
查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
| 金属离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 4.2 | 6.5 | 1.4 |
| 沉淀完全的pH | 6.7 | 9.7 | 3.7 |
(1)电子工业中用FeCl3溶液制作铜制印刷电路板,该反应的离子方程式为___________。
(2)操作I、操作Ⅱ所用的玻璃仪器除烧杯外还需要______________________。
(3)氯酸钠的作用是____________________________________________;反应A中氧化剂与还原剂物质的量之比是___________。
(4)调节pH的范围为___________,可以选择的试剂是___________(填序号)。
A.氨水 B.硫酸铜 C.氧化铜 D.氢氧化铜
(5)已知滤液Ⅱ中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:___________。
(6)若废液中CuCl2的含量为13.5%,则1吨废液理论上可提炼碱式碳酸铜________吨。
-
(12分)碱式碳酸铜[Cu2(OH)2C03]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
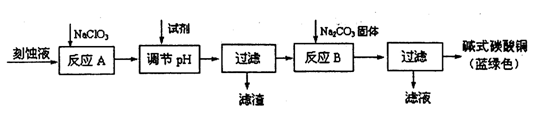
查阅资料知,通过调节溶液的酸碱性可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是________;
(2)调节溶液A的pH范围为________,可以选择的试剂是________.(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净________。
-
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
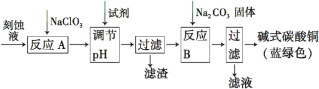
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
-
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
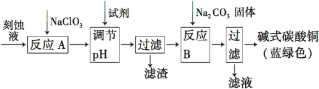
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.7 | 7.5 | 1.4 |
| 沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
-
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
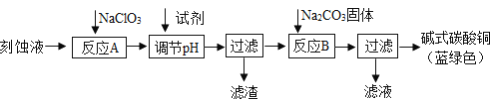
查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
-
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:
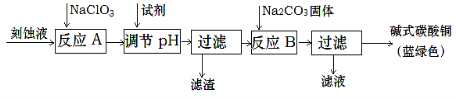
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是 ;
②反应A后调节溶液的pH范围应为 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净? 。
④造成蓝绿色产品中混有CuO杂质的原因是 。
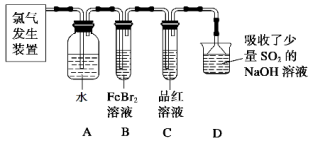
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
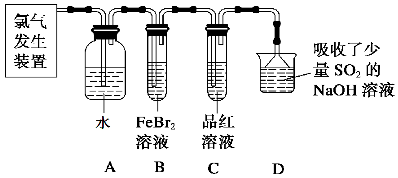
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 。此时B装置中发生反应的离子方程式是___________ _____。
③写出A溶液中具有强氧化性微粒的化学式 。若向A溶液中加入NaHCO3粉末,会观察到的现象是 。
-
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl−)制备碱式碳酸铜,其制备过程如下:
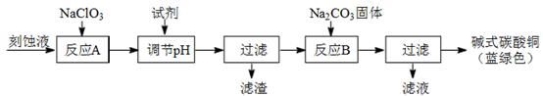
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是________________________________________________________________________________________________ ;
②反应A后调节溶液的pH范围应为________________________________________________________________________________________________________________________________________________________________________ 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净?________________________________________________________________________________________________________________ 。
④造成蓝绿色产品中混有CuO杂质的原因是________________________________________________________________________________________________________________________________________________________________ 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有________________________________________________________________________ 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因________ ________________。此时B装置中发生反应的离子方程式是________________________________________________________________________ 。
③写出A溶液中具有强氧化性微粒的化学式________________________________________________________________________________________________________________________________________________________ 。若向A溶液中加入NaHCO3粉末,会观察到的现象是________________________________________________________________________________________________________________________________ 。
-
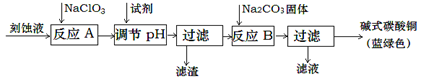
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)氯酸钠的作用是;滤渣的主要成分是(写化学式)。
(2)调节反应A后溶液的pH范围应为________。可以选择的试剂是________(填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净?。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明________________________________________。
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。________________________________。
-
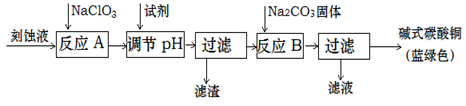
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)滤渣的主要成分是________(写化学式)。
(2)调节反应A后溶液的pH范围应为________。选择的试剂最合适的是________(填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是________。
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相应的离子方程式表示:
① 沉淀只有CuCO3:________;
② 沉淀只有Cu(OH)2 且放出气泡:________。
(5)碱式碳酸铜的组成可表示为:aCuCO3•bCu(OH)2•cH2O。要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量。而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为________(填序号,写一组即可)。
-
印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
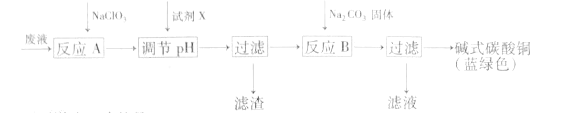
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去











