-
含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下;2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应相关的化学键键能数据如表一:
表一:
| 化学键 | 
| H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=___________kJ/mol
(2)在恒容密闭容器中充入2 molNO2与1molO2发生反应如下:
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
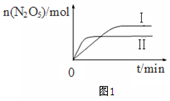
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示.常温下,该反应能逆向自发进行,原因是____________________________________________。

②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为______________________。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表二是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各lmol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为______________________。
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II: 2NO(g)+Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2=___________α1 (填“>”“<”或“=”)
-
含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的ΔH=_______________kJ/mol。
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g)  2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。常温下,该反应能逆向自发进行,原因是_______________________。
②下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 _________________________。

| 0.01 mol/L 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01 mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为_______________________。
氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
Ⅰ:2NO2(g)+ NaCl(s) NaNO3(s)+ ClNO(g) K1
NaNO3(s)+ ClNO(g) K1
Ⅱ:2NO(g)+ Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO2(g)+ 2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=_________(用K1、K2表示)
2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=_________(用K1、K2表示)
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应Ⅱ达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=___________;其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2________α1(填“>” “<”或“=”)
-
氮的化合物用途广泛。回答下列问题:
(1)在一定条件下,氮气能和水蒸气反应生成氨气和氧气2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H,与该反应相关的化学键键能数据如下:
| 化学键 | N≡N | H—O | N—H | O=O |
| E(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ·mol-1。
(2)在恒容密闭容器中充入2 mol N2O5与1molO2发生反应4NO2 (g) + O2 (g)  2N2O5 (g) △H。
2N2O5 (g) △H。
①已知在不同温度下测得N2O5的物质的量随时间的变化如图所示,该反应的△H_____0(填“>”“<”或“=”)。高温下该反应能逆向自发进行,其原因是___________________。

②下列有关该反应的说法正确的是_______(填标号)。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2 mol NO2和1molO2,再次达到平衡时,NO2的转化率增大
C.恒温恒容,当容器内的密度保持不变时,反应达到了平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图所示。则硼氢化钠燃料电池的负极反应式为_________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01mol・L—1的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________。
| 0.01mol・L—1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)  NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2 (g)  2CNO(g) K2
2CNO(g) K2
①4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②在恒温条件下,向2L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应Ⅱ达到平衡,测得10min内v(ClNO)=7.5×10-3mol・L-1・min-1,则平衡时NO的转化率α1=____;若其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2__α1(填“>”“<”或“=”)。
-
19.(10分)自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是 。
(2)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=﹣1269 kJ/mol
ⅱ. 
① 断开1 mol H-O 键与断开 1 mol H-N 键所需能量相差约______kJ;
② H-O 键比H-N键(填“强”或“弱”)______。
(3)下图是某压强下, N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。

① 图中b点,U(正)______ U(逆)。(填“>”、“=”或“<”)
② 图中a点,容器内气体n(N2):n(NH3)= 。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是 。
(5)电解法能将碱性溶液中的NO2转化为N2而除去,其电极反应式是 。
-
(15分)按要求回答下列有关问题。
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量。化学上,规定标准状况下稳定单质的生成热为0。几种物质的生成热:NH3(g)为mkJ·mol-1,H2O(l)为nkJ·mol-1。
反应的△H=产物的生成热之和---反应物的生成热之和
②几种化学键的键能数据如下:

上述反应中,△H=_______kJ·mol-1,H-N键的键能为_______kJ·mol-1。
(2)二氧化硫在一定条件下可以发生如下反应:
SO2(g)+NO2(g) SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol |
| N(SO2) | N(NO2) | N(NO) |
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
| | | | |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=_____________________;
②实验丙中,达到平衡时,NO2的转化率为____________;
③由表中数据可推知,Tl______T2(填“>”“<’’或“=”);
(3)对反应N2O4(g) 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:C12+CNO-+OH-→□+Cl-+CO32-+H2O(未配平)。最终阴、阳两极均有无色无味气体产生。

①铁电极应连接直流电源的____________(填写电极名称)。
②上述反应方程式配平后“□”内应填写________;
③阳极上发生的电极反应为2Cl--2e-=Cl2↑和_______________;
-
氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)  H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)  H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
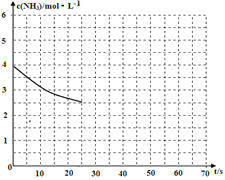
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
-
(11分)研究氮的固定具有重要意义.
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJ•mol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJ•mol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
下列能说明反应①达到平衡状态的是 (填字母).
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 .
-
(18分)研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:

则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
-
氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ• mol-1
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O △H=-1530.6kJ•mol-1。
2N2(g)+6H2O △H=-1530.6kJ•mol-1。
①合成氨反应的热化学方程式为__________________________________。
②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。
(2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g) CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol • L-1
CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol • L-1
①0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出2〜3 min内c(NH3)随时间(t)变化的曲线关系图:__________。
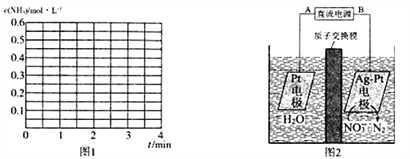
(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示:
①电源正极为___________(填“A”或“B”),阴极反应式为________________________________。
②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
-
氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g) 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。
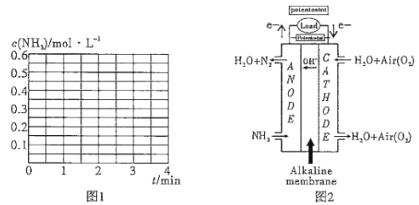
(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
2N2O5(g)

NaNO3(s)+ClNO(g) K1
2ClNO(g) K2
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___________(用K1、K2表示)












