-
氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3 CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为___________________________。以氯化铬晶体制备无水氯化铬的方法是_________________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):
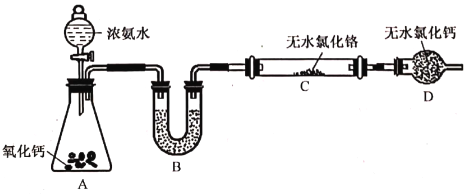
①装置A中发生反应的化学方程式为____________________________________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是______________________。
③装置B中盛放的试剂是___________,装置D的作用是______________________。
④有同学认为该装置有一个缺陷,该缺陷是______________________。
(3)氮化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为___________。
(4)工业上也可用Cr2O3与NH3在高温下反应制备CrN。相关反应的化学方程式为___________,提出一条能降低粗产品中氧含量的措施:______________________。
-
氮化铬(CrN)是一种良好的耐磨材料,实验室可用无水氯化铬(CrCl3)与氨气在高温下反应制备,反应原理为CrCl3+NH3 CrN+3HCl.回答下列问题:
CrN+3HCl.回答下列问题:
(1)制备无水氯化铬。氯化铬有很强的吸水性,通常以氯化铬晶体(CrCl3·6H2O)的形式存在。直接加热脱水往往得到Cr2O3,有关反应的化学方程式为______________,以氯化铬晶体制备无水氯化铬的方法是_____________________________。
(2)制备氮化铬。某实验小组设计制备氮化铬的装置如下图所示(夹持与加热装置省略):
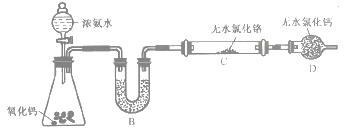
①装置A中发生反应的化学方程式为_____________________。
②实验开始时,要先打开装置A中活塞,后加热装置C,目的是___________________。
③装置B中盛放的试剂是____________,装置D的作用是_____________________。
④有同学认为该装置有一个缺陷,该缺陷是_______________________。
(3)氯化铬的纯度测定。制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN的质量分数为_____________(结果保留3位有效数字)。
-
氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3 CrN+3HCl,装置如图所示
CrN+3HCl,装置如图所示
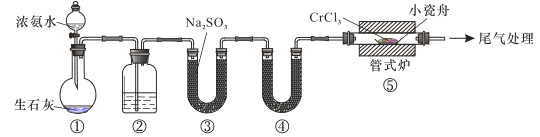
下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
-
氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3 CrN+3HCl,装置如图所示
CrN+3HCl,装置如图所示
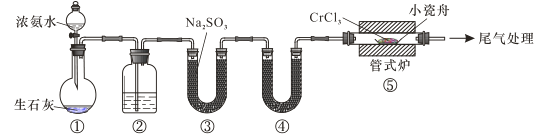
下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
-
无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
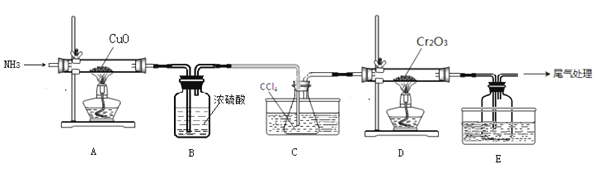
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
-
无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
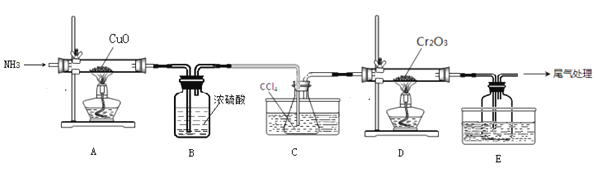
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
-
无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
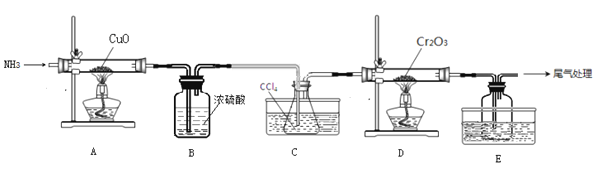
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
-
图示实验能达到实验目的是( )
A.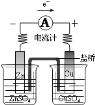 探究原电池原理
探究原电池原理
B.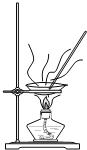 制备无水氯化铁
制备无水氯化铁
C.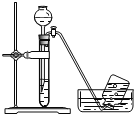 探究铁与水反应
探究铁与水反应
D. 收集氨气
收集氨气
-
(1 5分)无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾。氯化铝还易溶于乙醇、氯仿和四氯化碳。
实验室可用反应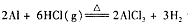 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
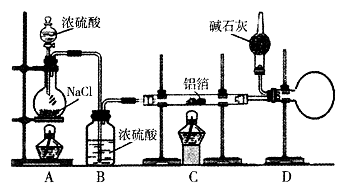
(1)A烧瓶中发生反应的化学方程式:
(2)以下三步操作的先后顺序为 (填序号)。
①点燃A处酒精灯
②点燃C处酒精灯
③滴加A处浓硫酸
(3)D中干燥管内碱石灰的作用是 。
(4)下列有关AICl3的说法合理的是 (填序号)。
①AlCl3水溶液能导电
②熔融态AlCl3能导电
③镁条能置换出AlCl3溶液中的Al
(5)实验室也可通过反应 制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是 。
(6)指出该实验装置可能存在的一种安全隐患: 。
-
氮化镁是一种浅黄色粉末,易水解生成氢氧化镁和氨气,常用于制备其它超硬、高导热、耐高温的氮化物。实验室用以下装置制取干燥、纯净的N2并与金属镁反应制取氮化镁。
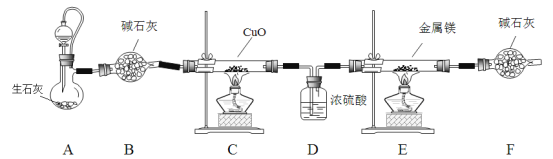
已知:Mg + 2NH3 Mg(NH2) 2+ H2
Mg(NH2) 2+ H2
回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是________;B、F中盛装碱石灰的仪器名称是_______。
(2)连接好装置进行实验前经检查装置的气密性良好。其他实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为_________________(填序号)。
(3)与分液漏斗相连通的橡胶管的作用是_________________________________。
(4)C中反应的化学方程式是_____________________________________________。
(5)D装置的作用是_______________________________________________。
(6)若24.0g镁放入E装置中,实验结束后称得E增加了7.0g,则氮化镁的产率是_________。
(7)设计简单实验证明E中得到的固体中含有氮化镁________________________________
CrN+3HCl。无水氯化钙对氨气具有突出的吸附能力,其吸附过程中容易膨胀、结块。回答下列问题:







 探究原电池原理
探究原电池原理 制备无水氯化铁
制备无水氯化铁 探究铁与水反应
探究铁与水反应 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
