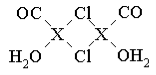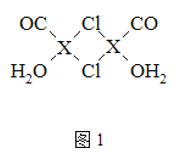-
在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2•2CO•2H2O。
回答下列问题:
(1)Cu在元素周期表中属于______(选填“s”、“p”、“d”或“ds”)区元素。研究人员发现在高温超导材料镧钡铜氧化物中含有Cu3+,基态Cu3+的电子排布式为______。
(2)C、N、O三种原子中的第一电离能最大的是______。NO3-离子的空间构型是______。
(3)CO与N2互称等电子体。
①它们的分子中都存在三个共价键,其中包含______个σ键,______个π键。
②下表为CO和N2的有关信息。
| 键的类型 | A-B(单键) | A=B(双键) | A≡B(叁键) |
| 键能(kJ/mol) | CO | 351 | 803 | 1071 |
| N2 | 159 | 418 | 946 |
根据表中数据,说明CO比N2活泼的原因是______。
(4)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
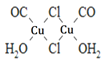
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
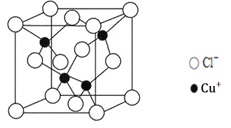
(5)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对CuCl晶体的X射线衍射图象分析,可以得出CuCl的晶胞如图所示,则距离每个Cu+最近的Cl-的个数为______。若晶体中Cl-呈立方面心最密堆积方式排列,Cl-的半径为a pm,晶体的密度为ρg/cm3,阿伏加德罗常数NA=______(列计算式表达)。
-
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:
2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
⑴X基态原子的电子排布式为 。
⑵C、H、O三种原子的电负性由大到小的顺序为 。
⑶X2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
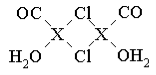
①与CO为互为等电子体的分子是 。
②该配合物中氯原子的杂化方式为 。
③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键 。
⑷XCl的晶胞如图所示,距离每个X+最近的Cl—的个数为 。
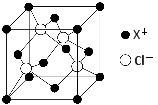
-
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
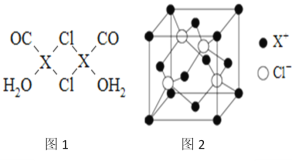
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
-
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______.
(2)C、H、O三种原子的电负性由大到小的顺序为______.
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
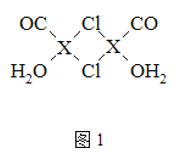
①与CO为互为等电子体的分子是______.
②该配合物中氯原子的杂化方式为______.
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______.
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______.XCl的化学式__________
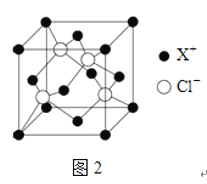
已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加德罗常数NA=_____________(无需化简,列式即可)。
-
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示

工业上制备该物质的反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O
(1)该配合物中金属阳离子的核外电子排布式为______________________;
(2)与CO为互为等电子体的阴离子是_______________(写一种即可)。
第二周期元素中,第一电离能介于B、N之间的元素除C外,还有_______(填元素符号)。
(3)该配合物中,氯离子的杂化方式为__________;用“ ”标出该物质中配位键。
”标出该物质中配位键。
(4)CuCl的晶胞如右图所示,距离每个Cu+最近的Cl-的个数为_______。

-
氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业。
(1).工业上氯化亚铜可由下列反应制备:
2CuSO4+ Na2SO3 + 2NaCl + Na2CO3 2CuCl ↓+ 3Na2SO4 + CO2↑。制备过程中需要20% 的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾 g,需要水 g。
(2).实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀。
已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl–)=0.032mol。请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量。
(3).由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO) (假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定)。
①该混合气体的摩尔质量是 g/mol;混合气体中n(CO2): n(CO和N2) = 。
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
-
某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2:CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是
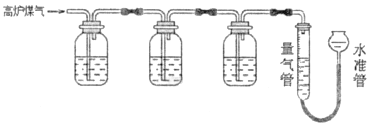
A. 采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B. 保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C. 反应结束,恢复至室温,调整水准管内液面与量气管液面齐平,可观察到量气管液面下降
D. 其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
-
某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2;CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是( )
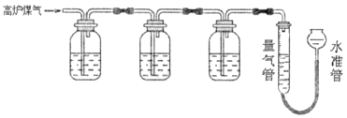
A.采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B.保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C.当三种气体被逐一吸收后,导出的气体中可能含有HCl
D.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
-
工业上常用CuCl作O2、CO的吸收剂,某同学利用如图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
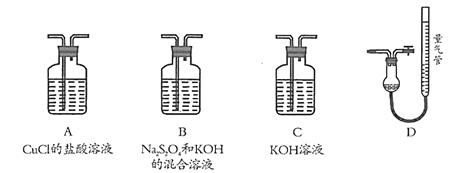
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(1)装置的连接顺序应为_______→D
(2)用D装置测N2含量,读数时应注意______________________。
-
测定铜合金中铜的含量,可以用稀硝酸来溶解样品,也可以用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。假设样品中其他成分不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式并标出电子转移的方向和数目________________________________________________________________________。
(2)在铜与双氧水、盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则电子转移的物质的量是______________。
(3)用双氧水和稀盐酸溶解样品与用稀硝酸溶解样品相比较,哪种更好?为什么?
________________________________________________________________________。