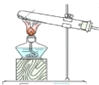
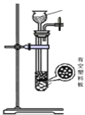
-
氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、C12反应合成氯化亚砜。发生如下反应:
①C12(g)+SO2(g) SO2C12(g) △H=-471.7kJ·mol-1
SO2C12(g) △H=-471.7kJ·mol-1
②SO2C12(g)+SCl2(g) 2SOC12(g)△H=-5.6kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1
567K时,在10L密闭容器中,充入一定量的C12、SO2和SCl2,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化(反应达到平衡时的温度与初始温度相同)如下图所示,起始各组分及达平衡时SO2C12(g)的物质的量如下表。
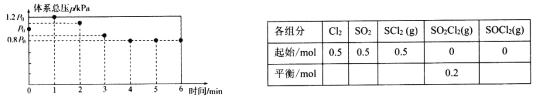
(1)0~1min,图中数据显示体系压强增大的原因是________________。
(2)0~4min内,v(C12)=_____mol·L-1·min-1,5min时SCl2的转化率为________。
(3)567K时,上述反应②的KP______。
(4)567K下,若扩大容器体积为20L,则平衡时c(SO2)_____(填“大于”“小于”或“等于”)上述反应平衡时的c(SO2)。
II.Li/SOCl2电池是一种高比能量电池,电解液为非水的LiAlC14的SOCl2溶液。正极为金属酞菁配合物(M-Pe,电池正极催化剂)附着的碳棒。正极催化过程为:SOCl2先与酞菁形成加合物,接着发生加合物的两步快速的电子转移,过程如图所示。
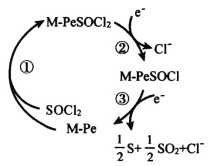
(5)上述正极催化过程M-PeSOCl2为_______(填“催化剂”或“中间产物”),放电过程中每转移1mol电子生成_____g硫单质。电池总反应的化学方程式为_______________________________________。
-
亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
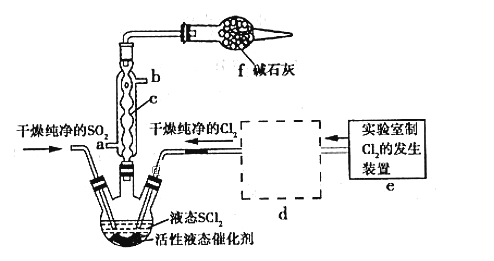
请回答下列问题:
(1)仪器c的名称是__________________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为_______________________
(3)已知SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是__________
(5)若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是________________________________________________________________________
-
亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:

请回答下列问题:
(1)仪器c的名称是_______________;
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为________________________________;
(3)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是_______________________;
(4)若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(5)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________________________________________。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应、产生白雾和带有制激性气味的气体。实验室合成SOCl2的原理为:SO2+Cl2+SCl2  2SOCl2,部分装置如图所示。
2SOCl2,部分装置如图所示。
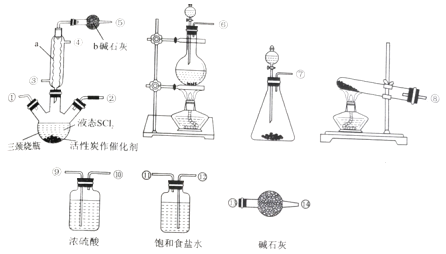
回答下列问题:
(1)仪器a 的名称是_______,装置b 的作用是__________。
(2)实验室制取SOCl2 时,所选仪器的连接顺序是⑥→______→①②←_____(某此仪器可以多次使用)。
(3)冷凝管口③是_____(填“进水”或“出水”)口,本实验中制备氯气的离子方程式为___________。
(4)将SOCl2 与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因________。
(5)已知SCl2 的沸点为50℃。实验结束后,将三颈烧瓶中的混合物分离开的实验操作名称是___。若反应中消耗标准状况下的Cl2的体积为1120 mL,最后得到纯净的SOCl26.76 g,则SOCl2 的产率为________(保留三位有效数字)。
(6)已知:SOCl2 +4NaOH= Na2SO3+2NaCl +2H2O。请设计简单的实验(可选试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液、品红溶液) 来验证氯化亚砜与NaOH 溶液反应后的溶液中存在Cl-__________________。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+C12+SCl2=2SOCl2,部分装置如下图所示,回答以下问题:
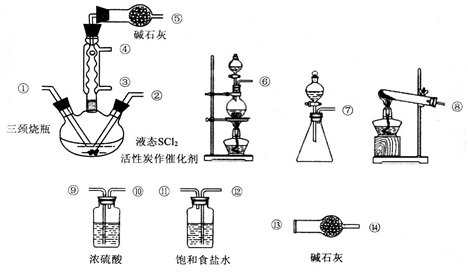
(1)实验室制取SOCl2在三颈烧瓶中合成,整个装置所选仪器的连接顺序是⑥→_______→① ②←_______(某些仪器可以多次使用)。
(2)冷凝管口③是_______口(填“进水”或“出水”),冷凝管上连接的干燥管的作用是_____________________________。
(3)实验室制C12的离子方程式为_______________。SOCl2与水反应的化学方程式为________________。
(4)已知SCl2的沸点为50℃。实验结束后,将三颈烧瓶中混合物分离开的实验操作名称是__________________。若反应中消耗的C12的体积为896m1。(已转化为标准状况,SO2足量),最后得到纯净的SOCl2 6.76g,则SOCl2的产率为__________(保留二位有效数字)。
(5)取少量的SOCl2加入足量NaOH溶液,振荡、静置得到无色溶液,检验溶液中存在的C1-的方法是____________________。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:
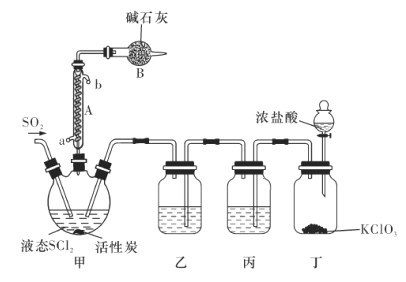
(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的 =1 .52×10-2,
=1 .52×10-2, =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、医药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并有带刺激性气味的气体产生。实验室合成原理为SO2+ Cl2+ SCl2=2SOCl2装置如下图所示。请回答以下问题:
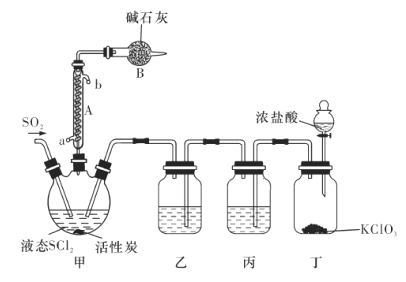
(1)仪器A的名称是________,装置乙中盛放的试剂是______装置B的作用是____________ 。
(2)装置丁中发生反应的离子方程式为___________________________。
(3)蒸干A1C13溶液不能得到无水A1C13,使SOCl2与A1C13·6H2O混合加热,可得到无水A1C13,试解释原因:_____________________________
(4)若反应中消耗的C12的体积为896 mL(已转化为标准状况下,SCl2、SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为________(保留三位有效数字)。
(5)常温下,将0. 01 mol SOCl2加人100 mL 0. 3 mol/L NaOH溶液中恰好完全反应,所得溶液呈__________________(填“酸”“碱”或“中”)性,溶液中所有阴离子的浓度大小顺序为________________。(已知H2SO3的 =1 .52×10-2,
=1 .52×10-2, =1.02×10-7)
=1.02×10-7)
(6)将少量SOCl2滴人5 mL 1 mol/L的AgNO3溶液中,有白色沉淀生成,该白色沉淀的成分是________________(填化学式)。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
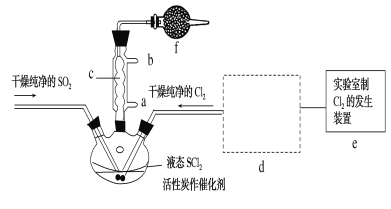
(1)下列四种制备SO2的方案中最佳选择是__。
| 方案 | A | B | C | D |
| 发生装置 | 
| 
| 
| 
|
| 所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__。
(3)仪器f的作用是__。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__或__溶液,证明脱水过程发生了氧化还原反应。
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,回答以下问题:
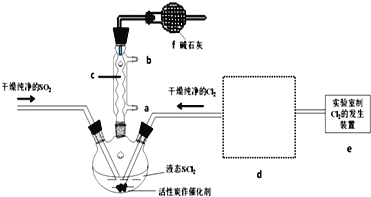
(1)仪器c的名称是________
(2)实验室制Cl2的化学方程式为________________________
(3)下列四种制备 SO2的方案中最佳选择是_______
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的作用分别是_______________。
(5)实验结束后,将三颈烧瓶中混合物分离开的方法是 _________(已知SCl2的沸点为50℃)
(6)试设计一个简单实验方案验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)____________________________________________。仪器自选。
限选的试剂:SO2、NaHCO3、酸性KMnO4、NaHSO3、蒸馏水、饱和石灰水、品红溶液、pH试纸。
(7)为测定某工厂的空气中二氧化硫含量,探究小组进行如下实验:在试管中加入一定量的含碘(I2)0.635mg的碘溶液,再加入2~3滴淀粉溶液,向试管中通入空气,当溶液由蓝色变为无色时恰好完全反应,共用去空气体积为500L。请通过计算判断出此空气中二氧化硫的浓度_____mg/m3。(化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
-
氯化亚砜(SOCl2)是一种液态化合物,沸点为 77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,(已知 SCl2的沸点为 50℃).
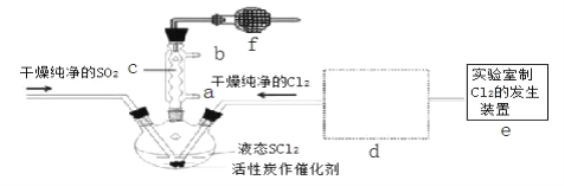
回答以下问题:
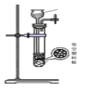
(1)下列四种制备 SO2的方案中最佳选择是____________________________
| 方案 | A | B | C | D |
| 发生装置 | 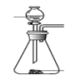
| 
| 
| 
|
| 所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHCO3固体 |
(2)以 MnO2和浓盐酸为原料制备 Cl2的离子方程式为___________________________
(3)仪器 f 的作用是_________________________________________________
(4)d 的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是_______________。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是 _________________________
(6)若用 SOCl2作 FeCl3•6H2O 的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量 FeCl3•6H2O 于试管中,加入过量 SOCl2,振荡,往试管中加水溶解,滴加____________或________溶液,证明脱水过程发生了氧化还原反应。
SO2C12(g) △H=-471.7kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1