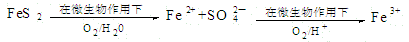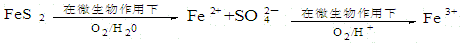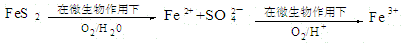-
煤的气化和液化是现代能源工业中重点考虑的综合利用技术。最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=-90.8 kJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=-412 kJ•mol-1
③CO(g)+2H2(g)⇌CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度
B.增大压强
C.降低温度
D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2 mol H-H键,同时生成3mol C-H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1mol CO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:
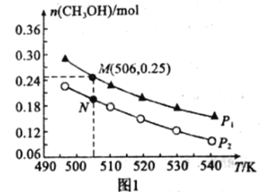
(1)压强P1______P2(填“>”、“<“或”=”)。
(2)M、N两点的化学反应速率:vM______vN(填“>”、“<“或“=”)
(3)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5 MPa)。
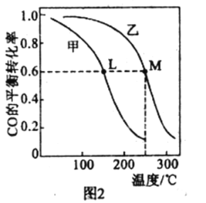
(4)甲、乙两个恒容密闭容器的体积相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)______2P(L),平衡常数:K(M)______K(L)(填“>”、“>”或“=”)。
-
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
①CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH1=-90.8 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-90.8 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
③CO(g)+2H2(g)  CH3OH(g) ΔH3
CH3OH(g) ΔH3
850 ℃平衡常数分别为K1=160、K2=243、K3=160,甲醇可以与乙酸反应制香料C H3OH(l)+CH3COOH(l)
H3OH(l)+CH3COOH(l)  CH3COOCH3(l)+H2O(l)。
CH3COOCH3(l)+H2O(l)。
(1)则反应ΔH3=____________,制香料反应的K的表达式________________。
(2)由CO合成甲醇时,以下有关该反应的说法正确的是________(填字母)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2 的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH 的产率
D.某温度下,将2 mol CO和6 mol H2 充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)850 ℃时,在密闭容器中进行反应①,开始时只加入CO2、H2,反应10 min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:v正________(填“>”“<”或“=”)v逆,该时间段内反应速率v(H2)=____________________________________________________。
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度/mol·L-1 | 0.2 | 0.2 | 0.4 | 0.4 |
(4)在一定条件下3 L恒容密闭 容器中,充入一定量的H2和CO2仅发生反应①,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
容器中,充入一定量的H2和CO2仅发生反应①,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
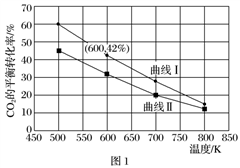
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol,
B:n(H2)=3 mol,n(CO2)=2 mol,曲线Ⅰ代表哪种投入方式________(用A、B表示)。
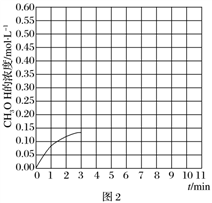
②在温度为500 K的条件下,按照A方式充入3 mol H2和1.5 mol CO2,该反应10 min时达到平衡,在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线。_____________________
-
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用 煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
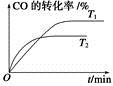
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
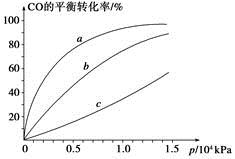
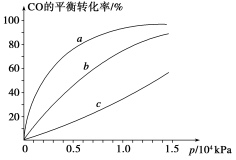
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)  CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
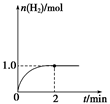
0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)  CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
-
煤气化和液化是现代能源工业中重点考虑的能源综合利用方案。最常见的气化方法为用煤生产水煤气,而当前比较流行的液化方法为用煤生产CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
则反应CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
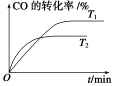
①T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇时,CO在250 ℃、300 ℃、350 ℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为________ ℃。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是____________。
③以下有关该反应的说法正确的是________(填序号)。
A.恒温、恒容条件下,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2 mol CO和6 mol H2充入2 L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为80%
(3)一定温度下,向2 L固定体积的密闭容器中加入1 mol CH3OH(g),发生反应:CH3OH(g)CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。

0~2 min内的平均反应速率v(CH3OH)=__________。该温度下,反应CO(g)+2H2(g)CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
A.平衡常数 B.CH3OH的平衡浓度
C.达到平衡的时间 D.平衡时气体的密度
-
煤炭燃烧时产生大量SO2、NO对坏境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
CH3OH(g)+H2O(g) △H1=-90.8kJ/mol
ii:C0(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2kJ/mol
CO2(g)+H2(g) △H2=-41.2kJ/mol
iii:CO(g)+2H2(g) CH3OH(g) △H3
CH3OH(g) △H3
850℃时,三个反应的平衡常数分别为K1=160、K2=243、K3=160。甲醇还可以与乙酸反应制香料,反应为:CH3OH(l)+CH3COOH(l) CH3COOCH3(l)+H2O(l)
CH3COOCH3(l)+H2O(l)
①△H3=_______制香料反应的平衡常数K 的表达式为____________。
②850℃时,在密闭容器中进行反应i,开始时只加入CO2、H2,反应10min后测得各组分的浓度如下表。比较正、逆反应的速率的大小:V正_____V逆 (填“>”、“<”或“=”)。
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度/mol/L | 0.2 | 0.2 | 0.4 | 0.4 |
(2)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低然煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
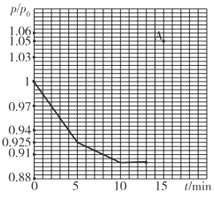
①0~5min内,该反应的平均反应速率V(N2)=______;平衡时NO的转化率为________。
②若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内p/p0的比值应在图中A点的______(填"上方”或“方”)。
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO),装置如图所示:
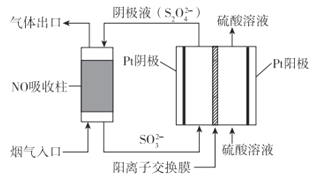
①阴极区的电极反应式为_________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标准状况下的体积为_______mL。
-
化学与生产、生活、社会密切相关,下列说法正确的是
A.煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法
B.蛋白质、淀粉、纤维素、葡萄糖、油脂等都能在人体内水解并提供能量
C.利用风能发电、使用太阳能热水器、应用无氟制冷剂、无磷洗衣粉均有利于降低大气中的二氧化碳
D.钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料
-
下列关于自然资源开发利用的说法错误的是
A.根据金属活泼性不同,冶炼金属采用的方法不同
B.通过煤的气化和液化等化学变化可将煤变为清洁能源
C.以石油、煤和天然气为原料可生产塑料、合成橡胶和合成纤维
D.从海带中提取碘经历的步骤有:灼烧 浸泡
浸泡 过滤
过滤 萃取
萃取 粗碘提纯
粗碘提纯
-
【化学——选修2:化学与技术】(15分)
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
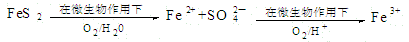
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式___________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是____________________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________。
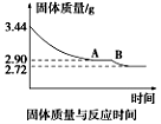
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。
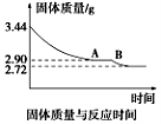
数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。
-
【化学——选修2:化学与技术】(15分)
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术通常包括煤的气化技术和液化技术。其中煤的液化技术又可以分为_____和______;
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
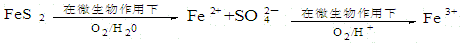
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为___________;第二步反应的离子方程式为____________。
(3)工业煤干馏得到的产品有焦炭、___________、___________等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______ _;
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________;
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是 ;
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。
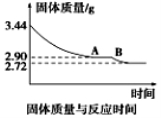
①石膏的化学式为_____________;
②图像中AB段对应化合物的化学式为_______________。
-
[化学一一选修2:化学与技术](15分)
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。
煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
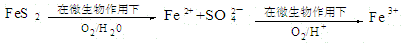
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为
;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________________________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:___________________________________________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是______ ________________________________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。