-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
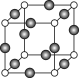
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
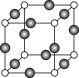
-
已知A、B、D、E、F五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子s轨道电子数是p轨道电子数的2倍;D原子中未成对电子数是同周期元素中最多的;E原子L层上有2对成对电子;F原子核外共有21个电子.
请回答下列问题:
(1)写出F元素基态原子的电子排布式为______.
F单质的晶体具有体心立方结构,则在该晶体的一个晶胞中,含有的原子数是______.
(2)B、D、E三种元素的第一电离能最大的是______(填元素符号),
(3)B与D原子结合形成的晶体目前是世界上最硬的材料,晶体结构类似金刚石,但硬度超过了金刚石,其原因是______.
该晶体中任一原子的配位数比E单质晶体中分子的配位数要______.
-
已知A、B、D、E、F五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子s轨道电子数是p轨道电子数的2倍;D原子中未成对电子数是同周期元素中最多的;E原子L层上有2对成对电子;F原子核外共有21个电子.
请回答下列问题:
(1)写出F元素基态原子的电子排布式为______.
F单质的晶体具有体心立方结构,则在该晶体的一个晶胞中,含有的原子数是______.
(2)B、D、E三种元素的第一电离能最大的是______(填元素符号),
(3)B与D原子结合形成的晶体目前是世界上最硬的材料,晶体结构类似金刚石,但硬度超过了金刚石,其原因是______.
该晶体中任一原子的配位数比E单质晶体中分子的配位数要______.
-
已知A、B、C、D、E为第二至第四周期的元素,其原子序数依次增大。A原子最外层电子数是其内层电子总数的2倍,B原子s轨道上的电子数与p轨道上的电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。请回答下列问题:
(1)基态E原子的价电子排布式为____。
(2)A和B中,第一电离能较大的是___(填元素符号);B的简单氢化物的立体构型是__,中心原子的杂化类型是___。
(3)A22-和B22+互为等电子体,B22+的电子式可表示为____,1 mol B22+中含有的π键数目为____。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键_______________。
(5)化合物DC2的晶胞结构如图所示,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是_____cm3(只要求列算式,阿伏加德罗常数的值为NA)。
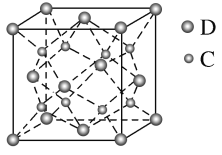
-
已知A、B、C、D、E是周期表中前四周期原子序数依次增大的五种元素。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。含E元素的硫酸盐溶液是制备波尔多液的原料之一。按要求回答下列问题:
(1)五种元素中第一电离能最大的是__________,电负性最大的是__________。(以上两空均填元素名称)
(2)基态E原子的价电子排布式为__________;E元素所在周期中基态原子的成单电子数最多的元素是__________(填元素符号)
(3)M分子中B原子的轨道杂化类型为__________,M分子中两种键角的大小关系是__________。(用∠XYZ表示,X、Y、Z代表元素符号)
(4)C3-的空间构型为__________;化合物CA3的沸点比BA4的高,其主要原因是__________。
(5)向E元素的硫酸盐溶液中通入过量的CA3,得到深蓝色的透明溶液,在此溶液中加入乙醇,析出深蓝色的晶体,此晶体中存在的化学键类型有__________。(填代号)
A.离子键 B.σ键 C.非极性共价健 D.配位键 E.金属键 F.氢键
(6)如图是D、E两种元素形成的化合物的晶胞结构示意图,D的配位数为__________。已知晶胞中最近两个D原子间距离为anm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)
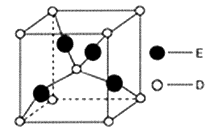
-
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为________________(填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;
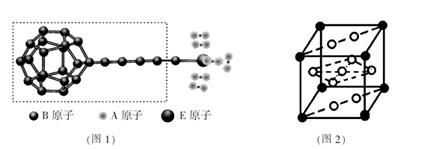
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H20 B. CH4C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为 ;已知其摩尔质量为Mg.mol-1,晶胞参数为apm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
-
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为 (填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;
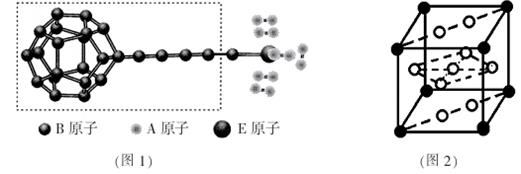
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H2O B.CH4C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为_______________;已知其摩尔质量为M g.mol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
-
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为 (填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;
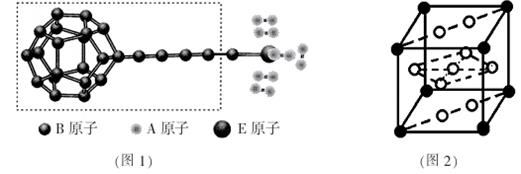
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H2O B.CH4C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为_______________;已知其摩尔质量为M g.mol-1,晶胞参数为a pm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
-
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式 。
(2)A、B、C、D电负性由大到小的顺序为________________(填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ,F与BD之间的作用力为 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成的某种新型储氢材料的理论结构模型如图1所示,图中虚线框内B原子的杂化轨道类型有 种;
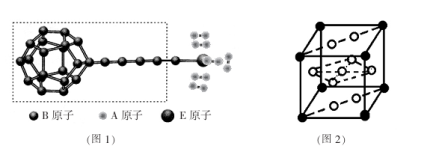
②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 (填标号);
A.H20 B. CH4 C.HF D.CO(NH2)2
③F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如图2所示,晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为 ;已知其摩尔质量为Mg.mol-1,晶胞参数为apm,用NA表示阿伏伽德罗常数,则该晶胞的密度为 g.cm-3。
”代表的微粒是________(用元素符号或离子符号表示),该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(写出表达式即可)。








