-
聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如图:
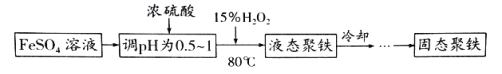
(1)FeSO4溶液显弱酸性的原因是_____(用离子方程式表示)。
(2)加入浓硫酸调节pH的作用是:①_____;②_____。
(3)写出加入H2O2发生反应的离子方程式:_____。
(4)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:Sn2++2Hg2++8Cl-=Hg2Cl2↓+SnCl6,Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
①用HgCl2除去过量的SnCl2的目的是_____。
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol·L-1K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80mL。则聚铁中铁元素的质量分数为_____%。
(5)某高效净水剂是由K2FeO4得到的,工业上以硫酸铁溶液、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是_____。
-
聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:

(1)酸浸时,采用100~140℃和2~3h,其目的是 。
(2)氧化时,需将溶液冷却到40℃以下,其目的是 。
(3)除Al3+时,先调节pH值到 。(参见表),得Fe(OH)3沉淀,过滤除去滤液,再用硫酸溶解Fe(OH)3得硫酸铁溶液。
| 开始沉淀 pH | 沉淀完全 pH |
| Al3+ | 3.5 | 4.7 |
| Fe3+ | 1.9 | 3.2 |
(4)Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应制备,该反应的离子方程式为 。
(5)水解聚合时,强力搅拌的目的是 ;检验透明橙红色液体中,其分散质直径在l~l00nm的简单方法是 。
-
某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:

请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)残渣2的主要成分是,设计实验证明你的结论(填操作、现象):_____________________。
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_________________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
-
某大学实验室对煤矸石(主要含Al2O3、SiO2及Fe2O3)制备聚合氯化铝{[Al2(OH)nCl6-n]m}(1≤n≤5,m≤10),简称PAC,是一种新型、高效的絮凝剂和净水剂}。其工艺流程如下:

请回答下列问题:
(1)用浓盐酸配制20%的盐酸所需的玻璃仪器有______________________________。
(2)加20%的盐酸酸浸,有关反应的离子方程式为_____________________________。
(3)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原
Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL.已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平).判断滴定终点的依据____ ;
残渣2中铁元素的质量分数为 _ .
(4)由澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是_______________,得到的PAC粗产品中可能含有的杂质离子是____________。
(5)从不引入杂质的角度来考虑,调节溶液pH的试剂可改为________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
(6)若m=n=2,则生成PAC的化学方程式是 .
-
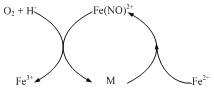
聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。
(2)盐基度[B= × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL−1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L−1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L−1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
-
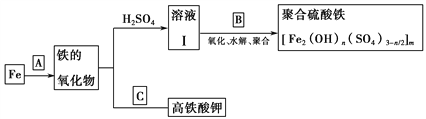
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
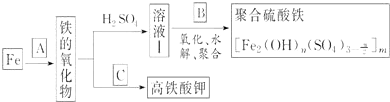
请回答下列问题:
(1)若A为H2O(g),写出反应方程式:_______________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)___________________;
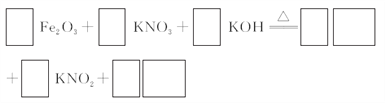
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH □_________+□KNO2+□__________
□_________+□KNO2+□__________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol・L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:
2Fe3++2I-═2Fe2++I2
I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象_______________________________;
②溶液Ⅰ中铁元素的总含量为____________g・L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将_________(填“偏高”“偏低”或“不变”)。
-
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
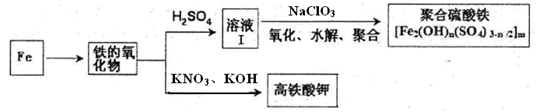
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是________(填标号)
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式:________。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□________+□KNO2+□________。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂________,滴定终点观察到的现象________。
②溶液I中铁元素的总含量为________g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”、“偏低”、“不变”)。
-
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
-
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
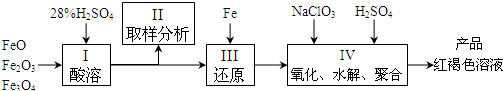
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______.
(a)玻璃棒 (b)烧杯 (c)烧瓶
(2)步骤II取样分析溶液中Fe2+、Fe3+的含量,目的是______和确定氧化Fe2+所需NaClO3的量:
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确保铁的氧化物酸溶完全 (c) 确定下一步还原所需铁的量
(3)完成步骤IV中的氧化还原反应:补充产物并配平:
______ Fe2++______ClO3-+______H+=______Fe3++Cl-+______
(4)聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2.根据下列提供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比.测定时所需的试剂______.
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
需要测定Fe2O3和______的质量(填写化合物的化学式).
-
硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
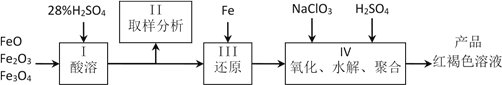
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是____________________,弊是________________________。聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂____________。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定____________和____________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧










