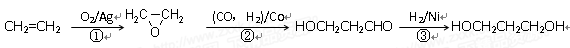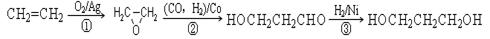-
CO、H2 是重要的工业原料,在高温、催化剂存在的条件下,可用甲烷 和水蒸气为原料制取它:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0
(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =_____。
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:
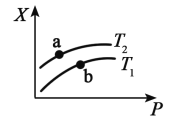
若 X 表示 CH4 的百分含量,则 T1_________T2(填“>”“<”“无法确定”,下同),X 还可 以表示_____(在下列选项中选填序号),a、b 两点的平衡常数 K(a) ____K(b)。
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3 时将 4mol H2O(g)与 a mol CH4 置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。
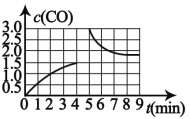
①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=__________________
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是____________
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)_____(填“具 有”或“不具有”)自发性。
-
利用焦炭或天然气制取廉价的CO和H2,再用于有机合成是目前工业生产的重要途径.回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O═CO+3H2.部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O (g)转变为1mol H2O(l)时放出44.0kJ热量.则CH4和水蒸气在高温下反应生成1mol H2的反应热为______.
(2)用CO和H2在一定条件下合成甲醇:CO+2H2⇌CH3OH.工业上采用稍高的压强(5MPa)和250℃,其可能原因是______.
| 反应温度/℃ | 平衡常数 | 反应温度/℃ | 平衡常数 |
| 667.30 | 200 | 1.909×10-2 |
| 100 | 12.92 | 300 | 2.42×10-4 |
(3)1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2 HOCH2CH2CHO
HOCH2CH2CHO  HOCH2CH2CH2OH
HOCH2CH2CH2OH
某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O  CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%.且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?______.
-
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式________。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
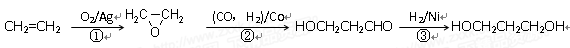
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭________吨、甲烷________吨,
才能满足生产需要。
-
 利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 molNH3,反应达平衡后测得平衡常数为K,此时CH4的转化率为a。则K和a的关系是K=。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
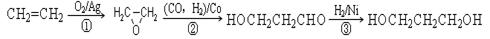
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
-
氢气是重要的化工原料,甲烷和水蒸气在高温和催化剂存在的条件下生成一氧化碳和氢气,工业上称为“甲烷蒸气转化法”。
(1)已知有关反应的能量变化如下图:

则甲烷和水蒸气反应生成一氧化碳和氢气的热化学方程式为_______________________________;
(2)已若该反应在700℃,1 MPa时,1 mol CH4与1 mol H2O在1 L的密闭容器中反应,反应中氢气浓度随时间的变化如右图,6min达到平衡。该温度下反应的平衡常数为______________(结果保留小数点后一位数字)。由第一次平衡到第二次平衡,平衡移动的方向是_____________,采取的措施可能是___________________。

(3)右图中a、b、c、d四条曲线中的两条代表压强分别为1Mpa、2Mpa时甲烷含量曲线,其中表示1Mpa的是________(填字母)。
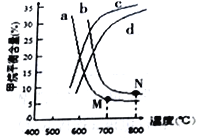
在实际生产中采用图中M点而不是N 点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是________________________________。
-
Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g)  CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
| 时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
| H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
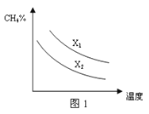
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为 ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O  HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
-
甲烷以天然气和可燃冰两种主要形式存在于地球上,储量巨大,充分利用甲烷对人类的未来发展具有重要意义。
(1)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:2CH4(g) C2H2(g)+ 3H2(g)。甲烷裂解时还发生副反应: 2CH4(g)
C2H2(g)+ 3H2(g)。甲烷裂解时还发生副反应: 2CH4(g) C2H4(g)+2H2(g)。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。
C2H4(g)+2H2(g)。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。
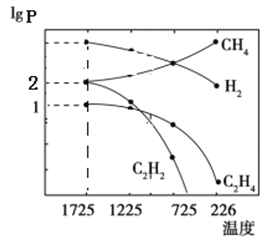
①1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为_______。
②1725℃时,若图中H2的lgP=5,则反应2CH4(g) C2H2(g)+ 3H2(g)的平衡常数Kp=_________(注:用平衡分压Pa代替平衡浓度mol/L进行计算)。
C2H2(g)+ 3H2(g)的平衡常数Kp=_________(注:用平衡分压Pa代替平衡浓度mol/L进行计算)。
③根据图判断,2CH4(g) C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
(2)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
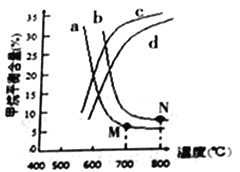
图中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示1MPa的是________(填字母)。在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是__________。
(3)利用CH4、CO2在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:
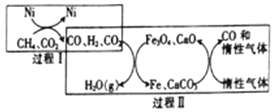
已知: CH4(g)+ H2O(g)  CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CH4(g)+ 2H2O(g)  CO2(g )+4H2(g) △H =+158.6 kJ/mol
CO2(g )+4H2(g) △H =+158.6 kJ/mol
则:
①过程II中第二步反应的化学方程式为__________。
②只有过程I投料比 =______,过程II中催化剂组成才会保持不变。
=______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为_______________。
-
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
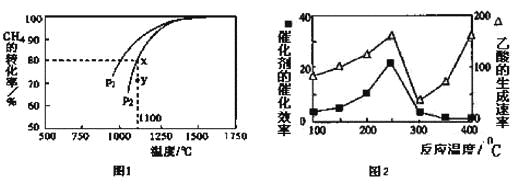
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
-
CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:
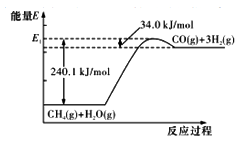
(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO CO2+H2
CO2+H2
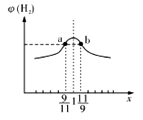
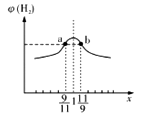
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。
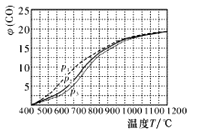
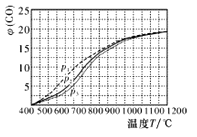
(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。
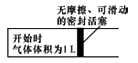
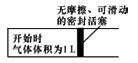
(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。
-
CH4和H2O在一定条件下, 可以转化为合成一系列有机化合物、氨的重要原料(CO+H2),这种方法称作甲烷水蒸气重整法制合成气,其能量变化如图:
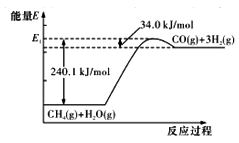
(1)甲烷水蒸气重整法制合成气的热化学方程式为_______;该反应只有在_____(填“高温”、“低温”或“常温”)才自发进行。
(2)下列有关甲烷水然气重整法制合成气的说法正确的是_____(填字母)。
A.相同条件下,该反应的逆反应更易发生
B.恒温恒容时充入一定量CO2,可促进CH4转化并可调节CO和H2的比例
C.若反应的高效催化剂为A,则A一定是CO和H2合成CH4的高效催化剂
D.恒温时向上述平衡体系中充入少量Ar,平衡一定不移动
E.有副反应:H2O+CO CO2+H2
CO2+H2
(3)在恒容密闭容器中充入2mol的CH4和H2O(g)混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图所示。请问a、b两点比较(填“>”、“<”、“=”);CH4的转化率a点____b点,a点CH4的浓度_____b点H2O(g)的浓度,氢气的产率a点_____b点。
(4)当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图,则压强由大到小的排序是_____;当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是_____________________。
(5)在下图左室充入1molCH4和H2O(g)混合气体(物质的量之比为1:1),恒温条件下反应建立平衡,测得CH4的转化率为50%,则其平衡常数为_________ 。
CO(g)+3H2(g) ΔH0