-
某硫酸盐在工农业生产上有广泛用途。它的组成可表达为KxFey(SO4)z·nH2O(其中Fe为+2价)。为测定它的组成可通过下列实验:
步骤Ⅰ:称取22.80 g样品,配制成100.00 mL溶液A。
步骤Ⅱ:量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点(滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+),消耗KMnO4溶液10.00 mL。
步骤Ⅲ:量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g。该反应的离子方程式为K++[B(C6H5)4]-=K[B(C6H5)4]↓。
(1)判断步骤Ⅱ滴定终点的现象是________,写出步骤Ⅱ中的离子反应方程式:________。
(2)已知常温下K[B(C6H5)4]的Ksp=2.0×10-13,欲使溶液中c(K+)≤1.0×10-5 mol·L-1,此时溶液中c{[B(C6H5)4]-}≥________mol·L-1。
(3)通过计算确定样品的化学式__________(写出计算过程)。
高三化学实验题中等难度题查看答案及解析
-
某硫酸盐在工农业生产上有广泛用途。它的组成可表达为KxFey(SO4)z·nH2O(其中Fe为+2价)。为测定它的组成可通过下列实验:
步骤Ⅰ:称取22.80 g样品,配制成100.00 mL溶液A。
步骤Ⅱ:量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点(滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+),消耗KMnO4溶液10.00 mL。
步骤Ⅲ:量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g。该反应的离子方程式为K++[B(C6H5)4]-=K[B(C6H5)4]↓。
(1)判断步骤Ⅱ滴定终点的现象是________,写出步骤Ⅱ中的离子反应方程式:________。
(2)已知常温下K[B(C6H5)4]的Ksp=2.0×10-13,欲使溶液中c(K+)≤1.0×10-5 mol·L-1,此时溶液中c{[B(C6H5)4]-}≥________mol·L-1。
(3)通过计算确定样品的化学式__________(写出计算过程)。
高三化学实验题中等难度题查看答案及解析
-
(12分)铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
高三化学填空题困难题查看答案及解析
-
铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入____________溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥__________mol·L-1。
(3)步骤③中判断滴定终点的方法是_____________________。
(4)通过计算确定铁钾矾的组成(写出计算过程)________________。
高三化学实验题困难题查看答案及解析
-
铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
高三化学实验题困难题查看答案及解析
-
铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
高三化学实验题困难题查看答案及解析
-
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将________(填“偏高”、或“偏低”或“不变”)。
(2)氨气常用________检验,现象是________。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
高三化学计算题中等难度题查看答案及解析
-
硫酸镍铵[(NH4)xNiy(SO4)m•nH2O]可用于电镀、印刷等领域.某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.3350g 样品,配制成100.00mL 溶液A;
②准确量取25.00mL 溶液A,用0.04000mol•L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA 标准溶液31.25mL;
③另取25.00mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56.00mL(标准状况).
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将______ (填“偏高”、或“偏低”或“不变”).
(2)氨气常用______ 检验,现象是______.
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)______.高三化学解答题中等难度题查看答案及解析
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
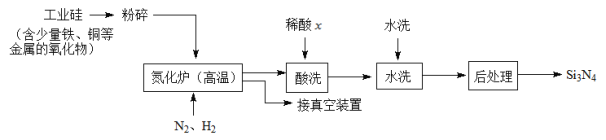
①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
高三化学综合题中等难度题查看答案及解析
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________;
(2)写出M原子核外能量最高的电子的电子排布式:__________________;
(3)常温下,不能与R单质发生反应的是___________(选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(4)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
II.氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2
Si3N4+CO
(5)Si3N4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C3N4的结构与Si3N4相似。请比较二者熔点高低。并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。_________________
(8)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_____________。
高三化学综合题中等难度题查看答案及解析