-
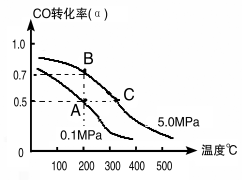
已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1  图2
图2 
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了 ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
-
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
-
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是( )
A.2SO2+O2 2SO3
2SO3
B.CO+H2O(g) CO2+H2
CO2+H2
C.CO2(g)+H2O H2CO3
H2CO3
D.Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
-
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是( )
A.2SO2+O2 2SO3
2SO3
B.CO+H2O(g) CO2+H2
CO2+H2
C.CO2(g)+H2O H2CO3
H2CO3
D.Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
-
将H2和CO以 =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
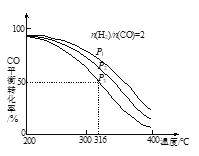
A.该反应的△H<0
B.压强大小:P1<P2<P3
C.在316℃时,该反应的平衡常数为0.25
D.若在P3和316℃时,起始时 =3,则达到平衡时,CO转化率大于50%
=3,则达到平衡时,CO转化率大于50%
-
CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
-
CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下一定达到最大限度的是
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1∶2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
-
CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
-
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1
-
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅲ中反应的平衡常数相同
B.容器Ⅰ、Ⅱ中正反应速率相同
C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和大于1
 图2
图2 
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。


