-
某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
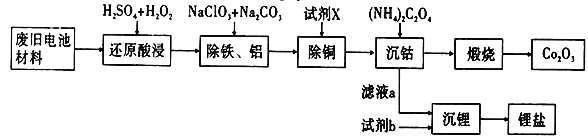
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中钴酸锂反应的离子方程式________________________________________;温度通常控制在40℃以下的原因是_______________________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是____________________,______________________。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式______________________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
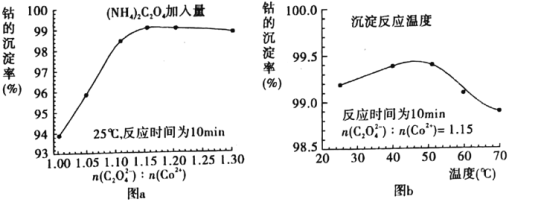
①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因________________________________________________________________________。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是_________________________________________________________。
-
某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
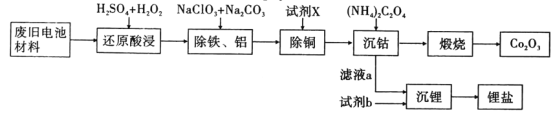
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
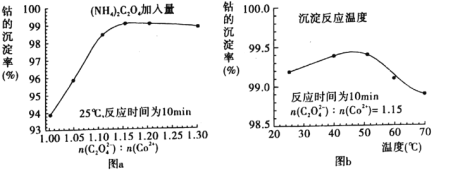
①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
-
某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
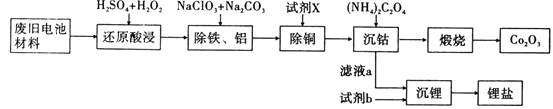
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为________,该过程温度通常控制在40℃以下的原因是________。
(2)“除铝铁”过程的NaClO3的作用是_______。
(3)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
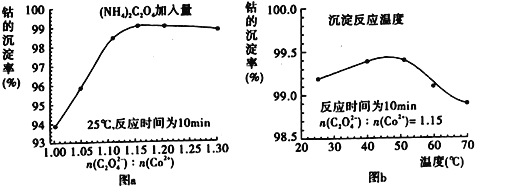
①随n(C2O42-):n(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因是_______。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___________。
(4)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如表所示。
| Li2SO4 | Li2CO3 |
| 0℃ | 36.1g | 1.33g |
| 100℃ | 24.0g | 0.72g |
结合数据分析,沉锂过程所用的试剂b是_________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,加热浓缩,________,洗涤干燥。
-
某废旧电池材料的主要成分为钴酸锂 ,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到
,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到 和锂盐。
和锂盐。
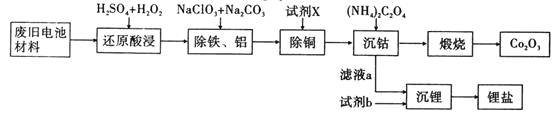
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的 离子生成
离子生成 而溶解。
而溶解。
(1)“还原酸浸”过程中, 发生反应的离子方程式为:_______________________________________,该过程温度通常控制在
发生反应的离子方程式为:_______________________________________,该过程温度通常控制在 以下的原因是:______________________________________。
以下的原因是:______________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是________________________,____________________________。
(3)“除铜”所用试剂X为 ,试写出该反应的离子方程式:_______________________________。
,试写出该反应的离子方程式:_______________________________。
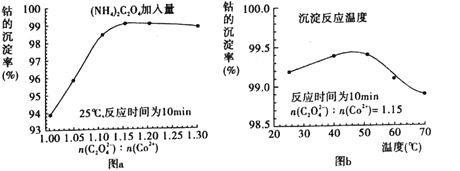
(4)“沉钴”过程中, 的加入量
的加入量 图
图 、沉淀反应的温度
、沉淀反应的温度 图
图 与钴的沉淀率关系如下图所示:
与钴的沉淀率关系如下图所示:
 随
随 :
: 比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
 沉淀反应时间为10min,温度在
沉淀反应时间为10min,温度在 以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。
以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。
(5)已知“沉锂”过程中,滤液a中的 约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
| 温度 | Li2SO4 | Li2CO3 |
| 0℃ | 36.1g | 1.33g |
| 100℃ | 24.0g | 0.72g |
结合数据分析,沉锂过程所用的试剂b是__________ 写化学式
写化学式 ,检验沉淀洗净的方法是___________________________________________________________。
,检验沉淀洗净的方法是___________________________________________________________。
-
随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
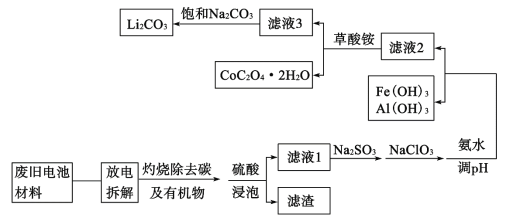
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
-
钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
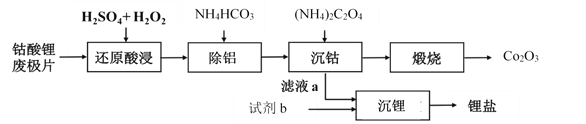
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□  □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
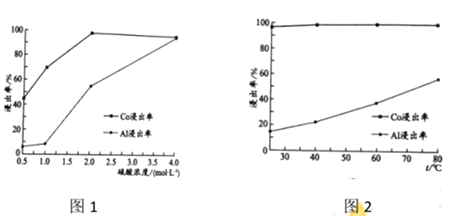
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
| 温度 | Li2SO4 | Li2CO3 |
| 0 oC | 36.1 g | 1.33 g |
| 100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
-
某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:
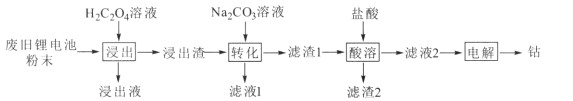
已知:Ksp(CoC2O4)=2.5×10-9,Ksp(CoCO3)=1.5×10-13
回答下列问题:
(1)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为 _______ ,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(2)“转化”中加入Na2CO3溶液发生反应的离子方程式为___________,该反应进行的程度较大,试用平衡常数K解释原因 _____ 。
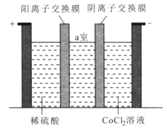
(3)“电解”时装置如图所示。阳极的电极反应式为______,电解后a室中的电解液可返回 ________工序继续使用。
(4)某废旧锂电池粉末中LiCoO2的质量分数为w,将mkg该废料进行回收利用,电解得到钴nkg,钴的回收率为____。
-
锂离子电池应用十分广泛,从废旧钻酸锂(LiCoO2)锂离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题。现欲利用图19所示的工艺流程回收废旧电池中的某些金属资源(部分条件未给出)。回答下列问题:
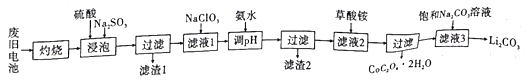
已知:①滤液1中阳离子有H+、Co2+、Fe2+、Al3+、Li+等;
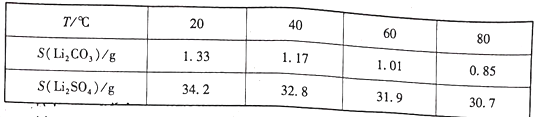
②两种物质不同温度下的溶解度如下表所示:
(1)钴酸锂( LiCoO2)钴元素的化合价为___________。
(2)浸泡时加入Na2SO3的主要目的是______________________;可用盐酸代替H2SO4和Na2SO3的混合液,但缺点是______________________。
(3)滤液1中加入NaClO3的主要目的是______________________(用离子方程式表示)。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mo·L-1时已沉淀完全)加入氨水调节pH的最小值是___________。(已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,1g3=0.52)
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是___________。
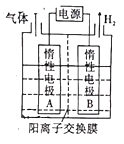
(6)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,利用如图所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为___________(填化学式)溶液;阳极电极反应式为______________________;电解过程中Li+向___________(填“A”或“B”)电极迁移。
-
(14分)某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用。某校研究小组尝试回收废旧正极材料中的钴。
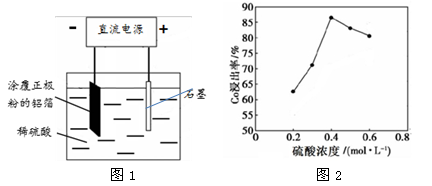
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2 + 4H+ + e- === Li+ + Co2+ + 2H2O 、 。
阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4) > 0.4 mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
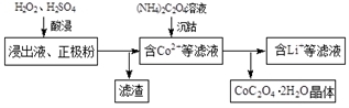
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该步骤一般在80℃以下进行,温度不能太高的原因是 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
a.c (NH4+)> c(C2O42-)>c (H+)>c (OH-)
b.c (H+) +c (NH4+) =c (OH-) + c(HC2O4-)+c(C2O42-)
c.c (NH4+)+ c (NH3•H2O ) = 2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)]
(3)已知所用锂离子电池的正极材料为x g,其中LiCoO2(M = 98 g·mol-1)的质量分数为a%,则回收后得到CoC2O4•2H2O (M = 183 g·mol-1)的质量不高于 g。
-
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
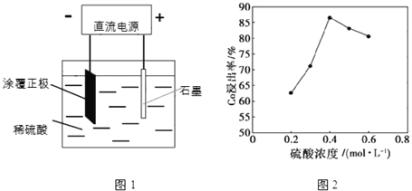
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol•L-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
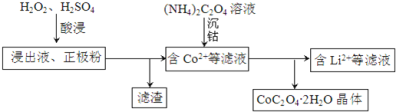
①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3•H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]





















