-
铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___摄取铁元素的原子光谱。
(2)FeC13的熔点为306℃,沸点为315℃。由此可知FeC13属于____晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____。
(3)铁氰化钾 K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为____。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____。
④铁氰化钾中,不存在___(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 ),则
),则 中的大Π键应表示为____,其中碳原子的杂化方式为____。
中的大Π键应表示为____,其中碳原子的杂化方式为____。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__mol配位键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。其中铁原子周围最近的铁原子个数为___;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
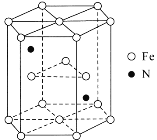
-
铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生活中用途广泛。
(1)基态S原子有___种能量不同的电子,其价电子排布图为___。
(2)硫能形成S2O 、SO
、SO 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O 的空间构型为___,SO
的空间构型为___,SO 的中心原子杂化方式为___。
的中心原子杂化方式为___。
(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的___区。
②SCN-的三种元素的电负性由大到小的顺序为___(用元素符号表示)。写出与SCN-互为等电子体的分子的分子式___(任写一种)。
③Fe(SCN)3中不存在的化学键有___(填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.σ键 F.π键
(4)部分卤化铁的熔点如下表所示:
| 卤化铁 | FeF3 | FeCl3 |
| 熔点/℃ | 1100 | 306 |
解释表中物质之间熔点差异的原因___。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。
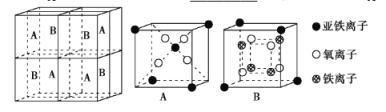
①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为___。
②己知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为___ nm(用含d和NA的代数式表示)。
-
铝及其化合物在生产、生中用途广泛。回答下列问题:
(1)在一定条件下,金属Al和Cu可以形成金属互化物Cu9Al4,基态Al原子核外电子有_____种不同的运动状态。基态Cu原子的核外电子排布式为______________。
(2)Na、Mg、Al三种元素中,第一电离能最大的是_______,原因是_____________。
(3)Al3+与Cl-易形成配位离子[AlCl4]-,其中Al与Cl之间形成的化学键类型为______(填“离子键”“极性键”或“非极性键”),Al原子的配位数为______,Al原子的杂化方式为_______,[AlCl4]-的空间构型为_____,试写出一种[AlCl4]-互为等电子体的微粒符号:____________。
(4)AlN的晶体结构与金刚石相似,晶胞结构如图所示。晶胞中含有_____个铝原子,若Al与N原子最近距离为apm,则该晶体的密度为______g/cm3。(阿伏加德罗常数用NA表示)
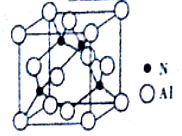
-
镍(28Ni)在金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为___________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:________、___________、_________。
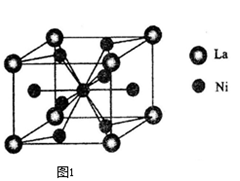
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构示意图如图1所示.则该晶体的化学式为 _________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式。
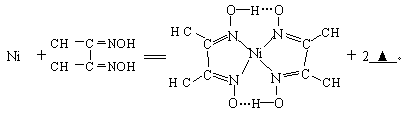
与Ni2+配位的N原子有______ 个,该配合物中存在的化学键有__________(填序号)。
A.共价键 B 离子键 C 配位键 D 金属键 E 氢键
-
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。
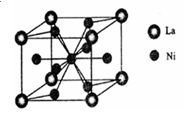
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
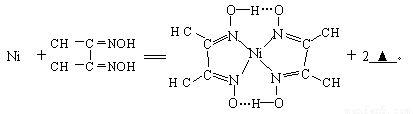
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
-
铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
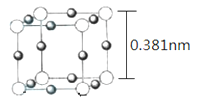
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
-
铁及其化合物在生产、生活中存在广泛用途。
(1)基态铁原子电子排布式为___,自然界中存在的54Fe和56Fe,它们互称为__。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是___。通常证明某溶液中含Fe3+的实验步骤是__。
(3)SO2有强还原性,写出其与FeCl3溶液反应的离子方程式___。若有0.4molFeCl3发生反应,则需要标准状况下的SO2__升。
(4)发黄的深井水通常含Fe3+,若向水中加入Na2CO3溶液,则产生红褐色沉淀和无色无味的气体。写出相应的离子方程式___。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
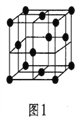
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。硫所在周期中,第一电离能最大的元素是___________。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________。
(3)H2S中S原子的杂化类型是__________;H2S的VSEPR模型名称为_________;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________。
(4)科学家通过X射线推测胆矾结构示意图1如下:
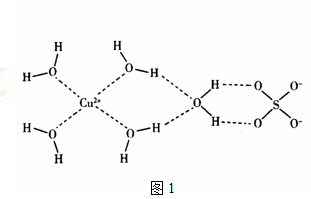
其中含有________个配位键,___________个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________。
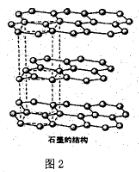
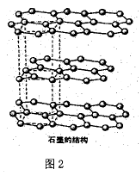
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____cm。
-
硫和碳及其化合物广泛存在于自然界中,并被人们广泛利用。回答下列问题:
(1)当基态原子的电子吸收能量后,电子会发生____,某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________。硫所在周期中,第一电离能最大的元素是___________。(填元素符号)
(2)写出一个与CO2具有相同空间结构和键合形式的分子的电子式__________________。
(3)H2S中S原子的杂化类型是__________;H2S的VSEPR模型名称为_________;H2S的键角约为94°,H2O的键角为105°,其原因是___________________________。
(4)科学家通过X射线推测胆矾结构示意图1如下:
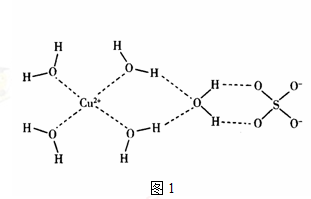
其中含有________个配位键,___________个氢键。
(5)已知Zn和Hg同属IIB族元素,火山喷出的岩浆是一种复杂的混合物,冷却时,许多矿物相继析出,其中所含的ZnS矿物先于HgS矿物析出,原因是_________________________________。
(6)碳的另一种同素异形体—石墨,其晶体结构如上图2所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为____个,已知石墨的密度为pg·cm-1,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为____cm。
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
),则
中的大Π键应表示为____,其中碳原子的杂化方式为____。













