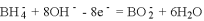-
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H=+49 kJ•mol-1
CO2(g)+3H2(g) △H=+49 kJ•mol-1
副反应:H2(g)+CO2(g) CO(g)+H2O(g) △H=+41 kJ•mol-1
CO(g)+H2O(g) △H=+41 kJ•mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
| 0.05 | C1 | 4.8 |
| c2 | C1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。
-
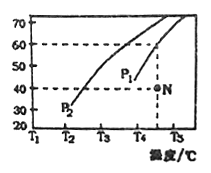
乙硼烷(B2H6)碱性燃料电池是一种新型电池,具有能量转化效率高、无污染等优点,其结构示意图如图所示。下列说法中不正确的是( )
A. 正极的电极反应式为O2+4e-+2H2O=4OH- B. 电池工作时,Na+通过阳离子交换膜向右移动
C. 转移6mol电子理论上消耗乙硼烷的质量为14g D. 消耗1molB2H6时负极参与反应的n(OH-)为12mol
-
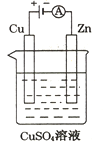
(9分)与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。下图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100 mL3.00 mol/L的CuSO4溶液。请回答下列问题:

(1) 在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出30kJ热量,表示该反应的热化学方程式为。
(2)N的电极反应式为________。
(3)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气________升
(标准状况下)
(4) 在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入乙醇 ________g?
-
钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为:

 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 充电时,阴极质量减小且Na+数目增加
B. 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
C. 放电时,Na+向正极移动
D. 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
-
钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为:

 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 充电时,阴极质量减小且Na+数目增加
B. 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
C. 放电时,Na+向正极移动
D. 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
-
钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn NaCoO2+Cn。下列说法不正确的是
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
-
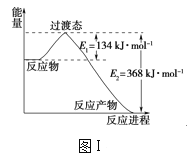
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=49.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为__。
(3)下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ·mol-1) | a | b | c | x |
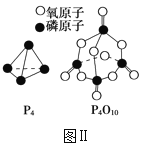
已知1molP4(g)完全燃烧生成P4O10(g)放出的热量为dkJ,P4和P4O10的结构如图Ⅱ所示,则上表中x=___(用含有a、b、c、d的代数式表示)。
-
NaBH4燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是( )
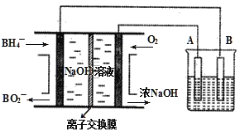
A.离子交换膜应为阳离子交换膜,Na+由左极室向右极室迁移
B.该燃料电池的负极反应式为BH4+8OH--8e-=BO2-+6H2O
C.电解池中的电解质溶液可以选择CuCl2溶液
D.每消耗2.24LO2(标准状况)时,A电极的质量减轻12.8g
-
 燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
燃料电池具有理论电压高、能量密度大等优点。以该燃料电池为电源电解精炼铜的装置如图所示。下列说法不正确的是
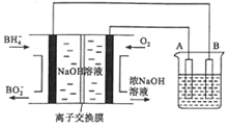
A. 每消耗2.24 (标准状况)时,A电极的质量减轻12.8g
(标准状况)时,A电极的质量减轻12.8g
B. 离子交换膜应为阳离子交换膜, 由左极室向右极室迁移
由左极室向右极室迁移
C. 该燃料电池的负极反应式为 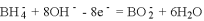
D. 粗铜中的Ag、Au沉在阳极区,电解质溶液的浓度基本保持不变
-
燃料电池具有能量利用率高、可连续使用和污染轻等优点,己成为一种发展前景十分广阔的化学电源。氢氧燃料电池是目前最成熟的燃料电池,它可以使用不同的电解质,如酸式、碱式、熔融碳酸盐、固体电解质等。回答以下问题:
(1)通入氧气的一极为___________极,若电解质溶液为硫酸溶液,负极反应式为________________,若电解质溶液为KOH溶液,正极反应式为__________________ 。
(2)若将氢气改为CH4,电解质溶液为KOH溶液,此时负极反应式为:_________________,—段时间后,电解质溶液的pH将_________________(填“升高”、“降低”或“不变”)。
(3)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。己知N2H4燃烧产物之一为空气中含量最高的一种气体。
①胼-空气燃料电池放电时:负极的电极反应式为:_____________________。
②假设使用肼-空气燃料电池作为下图电解过程的电源,当阴极增重1.28 g,则肼-空气燃料电池理论上消耗标准状况下的空气____________L。(假设空气中氧气体积分数为20%)
CO2(g)+3H2(g) △H=+49 kJ•mol-1
CO(g)+H2O(g) △H=+41 kJ•mol-1