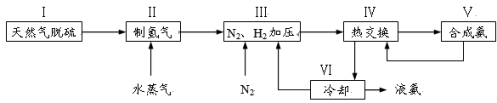-
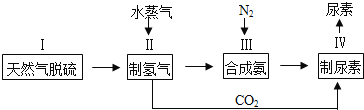
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:

(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是_____________。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______________。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为 ,请写出尿素的同分异构体中含有离子键的化学式_________。
,请写出尿素的同分异构体中含有离子键的化学式_________。
(5)已知CO2+ 2NH3 CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:
2NH3(g) ∆H= —92.4kJ•mol‾1 一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,写出氨水的电离方程式 。吸收产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出吸收液再生反应的化学方程式 。
(2)步骤II中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) △H=+206.4 kJ·mol-1
CO(g)+3H2(g) △H=+206.4 kJ·mol-1
②CO(g)+ H2O(g)  CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)  CO2(g)+4H2(g) △H= kJ·mol-1。
CO2(g)+4H2(g) △H= kJ·mol-1。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是(填编号) 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O蒸气反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
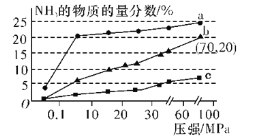
(4)下图1表示500℃、60.0MPa条件下,H2和N2为原料气的投料比与平衡时NH3体积分数的关系。根 据图中a点数据计算N2的平衡体积分数为 。
(5)依据温度对合成氨反应的影响,在下图2坐标系中,画出一定条件下的密闭容器内,从通入起始原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
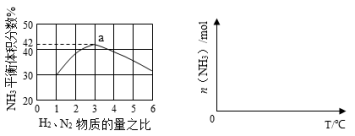
图1 图2
(6)简述本流程中提高合成氨原料总转化率的方法 。
-
(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H=—92.4kJ•mol‾1
2NH3(g) ∆H=—92.4kJ•mol‾1
一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:

对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
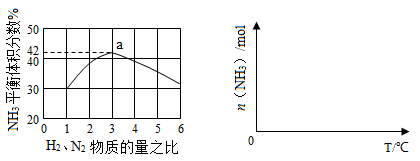
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ⋅mol-1
一种工业合成氨的简易流程图如图:
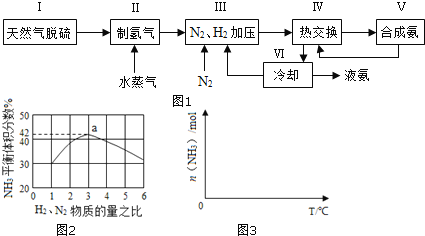
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___。
(2)步骤II中制氯气原理如下:
①CH4(g)+H2O(g)=CO2(g)+3H2(g) △H=+206.4kJ⋅mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ⋅mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为___。
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:___。
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图___。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是___(填序号),简述本流程中提高合成氨原料总转化率的方法:___。
-
(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为: N2(g)+3H2(g) 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
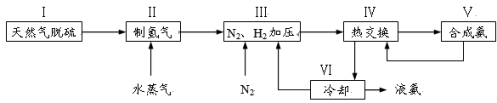
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。


32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
一种工业合成氨的简式流程图如下:
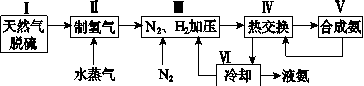
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:________________________________。
(2)步骤Ⅱ中制氢气的原理如下:
ⅰCH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
ⅱCO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
①对于反应ⅰ,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
②利用反应ⅱ,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
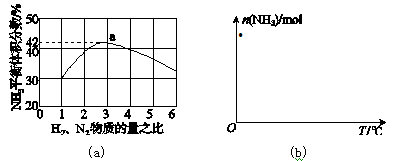
-
德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨。合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
一种利用天然气合成氨的简易流程如下:
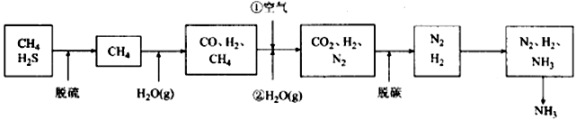
天然气先经脱硫,然后通过两次转化,再经过二氧化碳脱除等工序,得到氮氢混合气,进入氨合成塔,制得产品氨。
(1)根据化学平衡移动原理,为提高合成氨的生产效率,选择氨合成塔中适宜的生产条件是 。
(2)CH4与水蒸气制氢气的反应为CH4(g)+ H2O (g)  CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
CO (g) +3H2(g),在2 L的密闭容器中,将物质的量各1 mol的CH4和H2O (g)混合反应,CH4的平衡转化率与温度、压强的关系如下图所示:
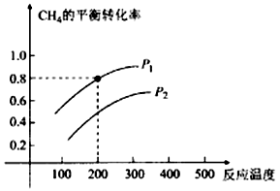
①该反应的△H 0(填﹥、﹤)。
②图中压强P1 P2(填﹥、﹤)。
③200℃时该反应的平衡常数K= (保留一位小数)。
(3)NH3经过催化氧化生成NO,以NO为原料通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O 3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
3NH4NO3+2HNO3,试写出以惰性材料作电极的阴极反应式: ;阳极反应式: ;电解过程中需要补充一种物质才能使电解产物全部转化为NH4NO3,该物质是 。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
(1)已知:2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g)
2H2O(g) ΔH=-483.6 kJ·mol-1。则4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
2N2(g)+6H2O(g) ΔH=______kJ·mol-1。
(2)如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=__kJ·mol-1;使用催化剂之后,正反应的活化能为___kJ·mol-1(已知:加入催化剂后,反应分两步进行,反应的活化能是两个过程中需要吸收能量较大的反应的活化能)。
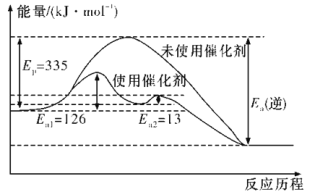
(3)从平衡视角考虑,工业合成氨应该选择常温条件,但实际工业生产却选择500 ℃左右的高温,试解释其原因: ____________________________。
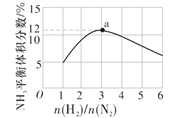
(4)如图表示500 ℃、60 MPa条件下,原料气投料比与平衡时NH3的体积分数的关系。根据图中a点数据计算N2的平衡体积分数为__。
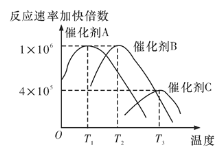
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如图所示(其他条件相同),则实际生产中适宜选择的催化剂是__(填“A”“B”或“C”),理由是________。
(6)如图是当反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
①曲线a、b对应温度较高的是___(填“a”或“b”)。
②列出b点平衡常数的计算式Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为: ,一种工业合成氨,进而合成尿素的简易流程图如下:
,一种工业合成氨,进而合成尿素的简易流程图如下:
(1)步骤II中制氢气原理如下:


恒容容器中,对于以上反应,能加快反应速率的是______.
 升高温度
升高温度  充入He
充入He  加入催化剂
加入催化剂  降低压强
降低压强
(2)天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______.
(3) 和
和 在高温、高压、催化剂条件下可合成
在高温、高压、催化剂条件下可合成 ,反应的化学方程式______
,反应的化学方程式______ 以
以 、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:______.
(4)已知
 ,若合成尿素的流程中转化率为
,若合成尿素的流程中转化率为 时,100吨甲烷为原料能够合成______吨尿素.
时,100吨甲烷为原料能够合成______吨尿素.
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:

CO(g)+3H2(g) CO(g)+H2O(g)
CO2(g)+H2(g)
,请写出尿素的同分异构体中含有离子键的化学式_________。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。