-
钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS 等)制备钼酸钠晶体的部分流程如下:
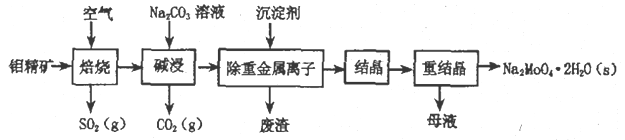
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;焙烧时为了使钼精矿充分反应,可采取的措施是______________(答出一条即可)。
(2)写出焙烧附生成MoO3 的化学方程式为:_________________。
(3)写出“碱浸”反应的离子方程式:____________________。
(4)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
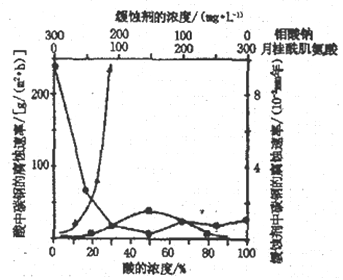

①当硫酸的浓度大于90%时,腐蚀速率几率为零,原因是__________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______________。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,SO42-的去除率是__________。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=40×10-8加入Ba(OH)2固体引起的溶液体积变化可忽略。]
-
钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
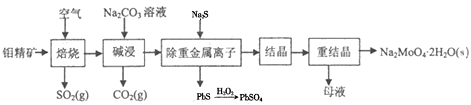
(1)Na2MoO4•2H2O中钼元素的化合价为__________;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是__________(答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为__________mol;
MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为__________mol;
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为__________;
(5)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率为97.5%,已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=__________[加入Ba(OH)2固体引起的溶液体积变化可忽略]
-
钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
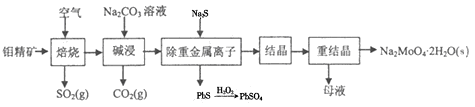
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配平),该反应中氧化产物是______(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_______mol;
MoO3+SO2(未配平),该反应中氧化产物是______(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_______mol;
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率为97.5%,已知:碱浸液中c(MoO42-)=0.40mol/L,c(SO42-)=0.040mol/L,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=_______[加入Ba(OH)2固体引起的溶液体积变化可忽略]
-
钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:
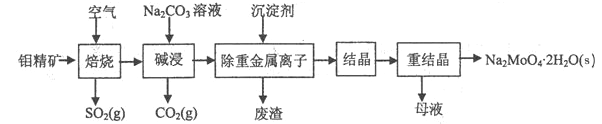
(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2 __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
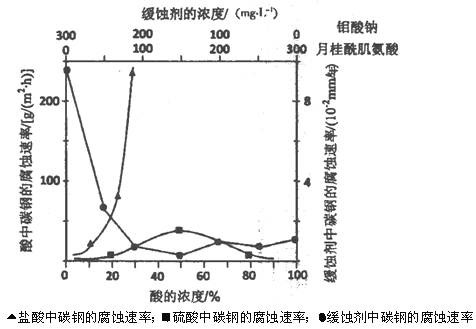
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
-
钼酸钠晶体(Na2MoO4•2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示
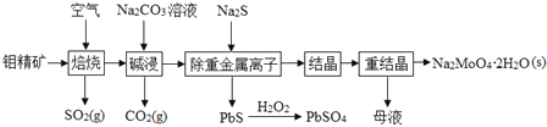
(1)Na2MoO4•2H2O中钼元素的化合价为____________。
(2)焙烧时为了使钼精矿充分反应,可采取的措施是____________(答出一条即可)。
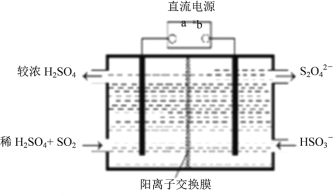
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2 MoO3+SO2(未配 平),该反应中氧化产物是____________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_________mol。利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为__________________________,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成,该反应的离子方程式为____________________________________________________。
MoO3+SO2(未配 平),该反应中氧化产物是____________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_________mol。利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为__________________________,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成,该反应的离子方程式为____________________________________________________。
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为__________________________。
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因____________________________________。
(6)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时, SO42-去除率为97.5%,已知碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.040mol•L-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=________________[加入Ba(OH)2固体引起的溶液体积变化可忽略]。
-
(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
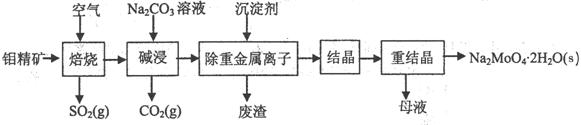 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
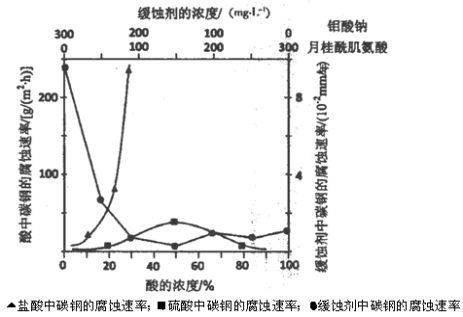
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2  Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
-
钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
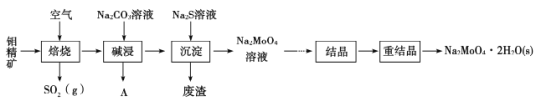
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
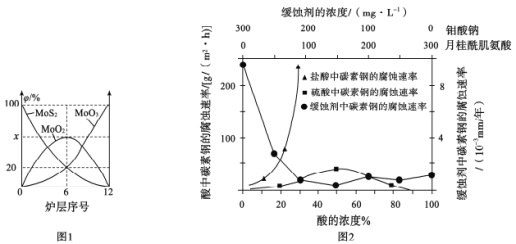
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
-
【化学选修2:化学与技术】
钼酸钠晶体(Na2MoO4·2H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如下:
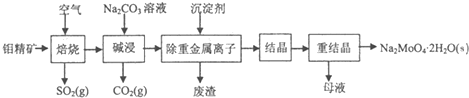
(1)写出“碱浸”反应的离子方程式__________________;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42-.当BaMoO4开始沉淀时,SO42-的去除率是____________;[已知:碱浸液中c(MoO42-)=0.40mol•L-1,c(SO42-)=0.04mol•L-1,Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是__________________;
(4)如图是碳钢在3种不同介质中的腐蚀速率实验结果:
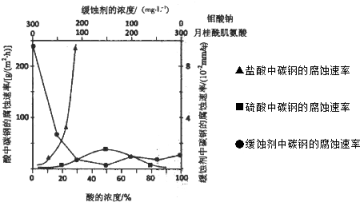
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是________________;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2.NaNO2的作用是_________________;
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg•L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为__________;
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
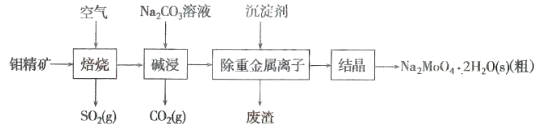
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
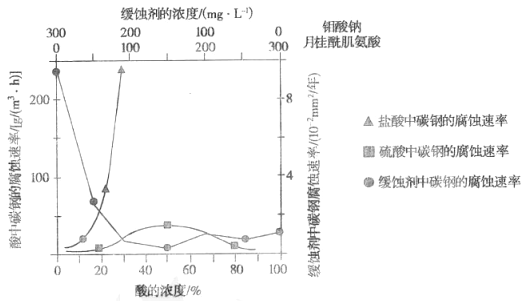
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:
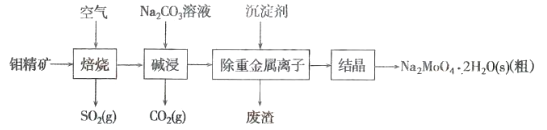
(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:
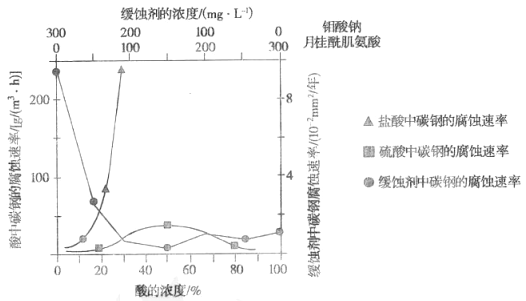
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。

MoO3+SO2(未配 平),该反应中氧化产物是____________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_________mol。利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为__________________________,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成,该反应的离子方程式为____________________________________________________。








 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________







