-
(11分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气, 因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铝)等为原料制取过氧化钙(CaO2)的流程。
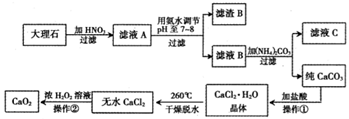
请回答下列问题:
(1)①中实验操作顺序为________(填序号)。
a.过滤 b.蒸馏 C.分液 d.蒸发结晶
(2)用氨水调节pH至7~8的目的是________。
(3)写出生成滤渣B的离子方程式________。
(4)若在滤液C中,加入HNO3,使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+)________c(N03-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式________。一段时间后,再加入氢氧化钠溶液,调节溶液的pH至9~11, 出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~ll的原因________。
-
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
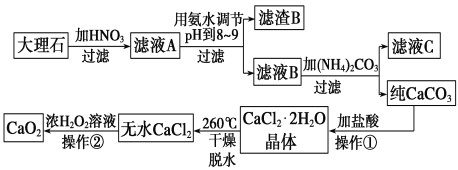
请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
-
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
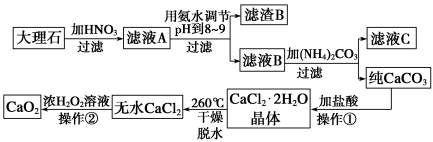
请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A溶解 B过滤 C蒸馏 D分液 E蒸发结晶
(2)用氨水调节pH至8~9的目的是____________________。
(3)若测得滤液C中c(CO)=10-3 mol/L,则Ca2+________(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH)________c(NO)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至9~11的原因_____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率________。
-
过氧化钙 难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石
难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石 主要杂质是氧化铁
主要杂质是氧化铁 等为原料制取过氧化钙
等为原料制取过氧化钙 的流程。
的流程。
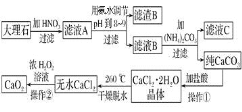
请回答下列问题:
 操作
操作 应包括下列操作中的________。
应包括下列操作中的________。 填序号
填序号
A 溶解  过滤
过滤  蒸馏
蒸馏  分液
分液  蒸发结晶
蒸发结晶
 用氨水调节pH至
用氨水调节pH至 的目的是________。
的目的是________。
 若测得滤液C中
若测得滤液C中 ,则
,则 ________
________ 填“是”或“不”
填“是”或“不” 沉淀完全。
沉淀完全。 已知
已知 时即可视为沉淀完全;
时即可视为沉淀完全;
 若在滤液C中,加入
若在滤液C中,加入 使溶液呈酸性以得到副产物
使溶液呈酸性以得到副产物 ,则酸化后溶液中
,则酸化后溶液中 ____________
____________ 填“
填“ ”、“
”、“ ”、“
”、“ ”、“
”、“ ”或“
”或“ ”
” 。
。
 操作
操作 是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至
是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至 ,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至
,才出现大量沉淀。写出该反应的化学方程式________;用简要的文字解释用氢氧化钠调节pH至 的原因_________。
的原因_________。
 已知大理石含
已知大理石含 的质量分数为a,
的质量分数为a, 大理石可以制得
大理石可以制得 ,请计算:
,请计算: 转化为
转化为 过程中,Ca原子的利用率________。
过程中,Ca原子的利用率________。
-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
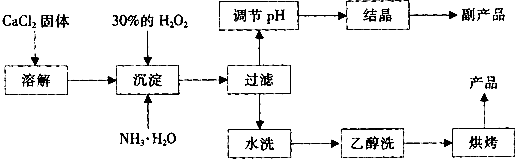
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
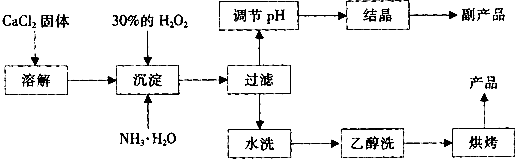
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
过氧化钙( CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
Ⅰ.CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O===CaO2·8H2O↓+2NH4Cl。实验步骤、反应装置如图所示,请回答下列问题:


(1)仪器a的名称______________________________________________________________。
(2)①沉淀反应时常用冰水浴控制温度在0 ℃左右,其可能原因是____________________(写出两点)。
②过滤后洗涤沉淀的试剂最好用________(填字母)。
A.热水 B.冷水
C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由
________________________________________________________________________。
Ⅱ.产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.100 0 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表:

已知:①H2O2不稳定,加热、加入某些金属离子或加碱均有利于其分解。
②产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%。
(4)用KMnO4滴定,达到滴定终点时的现象是_____________________________________。
(5)该产品的“产品稳定性”=__________________________________________________。
-
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
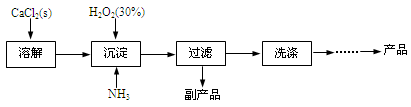
(1)用上述方法制取CaO2·8H2O的化学方程式是________。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①________;②________。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为________________________。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
-
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
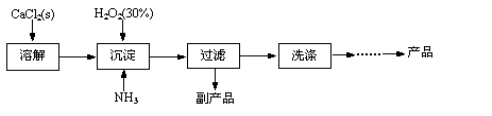
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
| | | |
表1. KMnO4标准溶液滴定数据
-
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下:
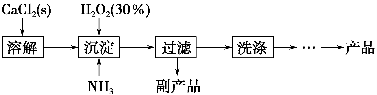
(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |
| | | |











