-
从海水中提取并制备碳酸锂,可以提高海水的综合利用价值,满足工业上对碳酸锂的需求。制备碳酸锂的一种工艺流程如下:
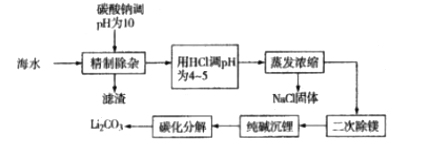
已知:①海水中某些离子浓度如下:
| 离子 | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
| 浓度(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
②碳酸锂的溶解度:
| 温度(℃) | 0 | 10 | 30 | 50 | 70 | 90 |
| 溶解度(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
 几种难溶电解质的溶度积(25℃):
几种难溶电解质的溶度积(25℃):
| 物质 | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
| Ksp | 2.5×10-2 | 6.8×10-6 | 2.3×10-11 | 2.8×10-9 | 6×10-10 |
请回答下列问题:
 精制除杂阶段的滤渣为MgCO3、______
精制除杂阶段的滤渣为MgCO3、______ 写化学式
写化学式
 用HCl调pH为4~5的目的是_________。
用HCl调pH为4~5的目的是_________。
 二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
 沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
| 序号 | 
| 沉淀质量(g) | Li2CO3含量(%) | 锂回收率(%) |
| 0.9:2.0 | 10.09 | 92.36 | 77.67 |
| 1.0:2.0 | 10.97 | 90.19 | 82.46 |
| 1.1:2.0 | 11.45 | 89.37 | 85.27 |
| 1.2:2.0 | 12.14 | 84.82 | 85.85 |
综合以上信息及考虑实际生产时的原料成本,应按照______ 填序号
填序号 中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
 沉锂温度需控制在
沉锂温度需控制在 ,主要原因是______。
,主要原因是______。
 碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
-
海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:

回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是 。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为 ,制取它的化学方程式为 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为 。
②步骤d中的“一定条件”指的是 。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗? (填“同意”或“不同意”),请说出你同意或不同意的理由 。
-
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是
②实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为__________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:
卤水 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg
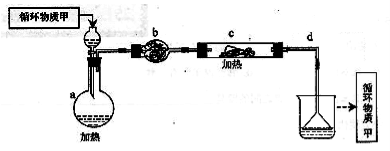
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
①上图中,装置a由 、 、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是
-
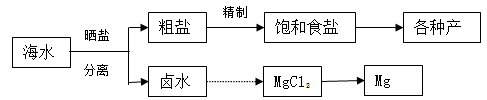
海水中蕴藏着丰富的资源.海水综合利用的流程图如下:
请回答下列问题:
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是____________.
②实验室用惰性电极电解100mL NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为____________(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84”消毒液,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式____________.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品,从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg.
①步骤d中的“一定条件”指的是__________,目的是__________.
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点__________.
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?__________,请说出你同意或不同意的理由_____________.
-
Ⅰ海水中蕴藏着丰富的资源.海水综合利用的流程图如下.
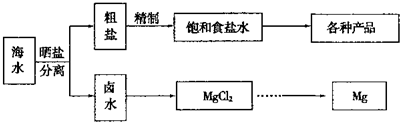
用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是________.
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式:________.
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al2O3和SiO2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
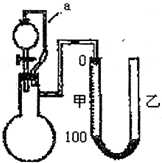
(1)装置中导管a所起的作用是________.
(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意________.
A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是________,不选择另一种试剂的理由是________.
-
海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
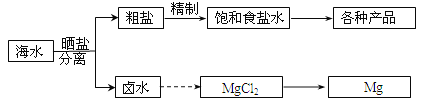
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
d.将MgCl2•6H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
-
(12分)海水中蕴藏着丰富的资源,海水综合利用的流程图如下。
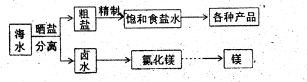
(1)用NaC1做原料可以得到多种产品。
①工业上由NaC1制备58.5kg金属钠时,可生成标准状况下的氯气________L。
②实验室用惰性电极电解氯化钠稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式________。
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgC12粗产品。租产品的溶液中含有的Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)3呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。
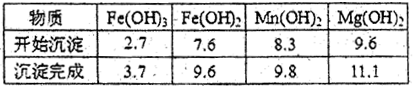
若只加入题(1)中得到的一种产品即可达到上述除杂目的,则该产品的化学式为________,最终控制溶液的pH值为________。MgC12粗产品在精制净化后,熔融、电解可得镁单质。环境专家认为可以用金属镁将水体中的NO3—还原为N2,从而消除污染。请补充完整以下离子方程式并配平:
________NO3—+________Mg+________H2O=________N2↑+________Mg(OH)2+________
(3)碘在地壳中主要以NaIO3形式存在,在海水中主要以,I—的形式存在。几种粒子之间有如下转化关系:
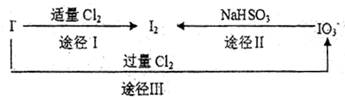
①如以途径I制取I2,加的、C12要适量;如过量就会发生途径Ⅲ的副反应,在该副反应产物中,IO3—。与C1—物质的量之比1:6,则氧化剂剂还原剂物质的量之比为________。
②如以途径Ⅱ在溶液中制I2,反应后溶液显酸性,则反应的离子方程式是________。
-
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
① 工业上由NaCl制备金属钠的化学方程式是_______________________________。
②电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:____________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:
卤水 Mg(OH)2
Mg(OH)2 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
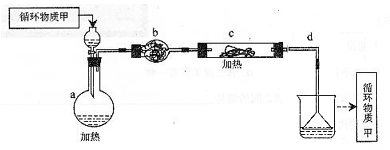
①上图中,装置a由________、________、双孔塞和导管组成。
②循环物质甲的名称是。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是________。
④装置b中填充的物质可能是________。
-
下列与化工生产相关描述不合理的是
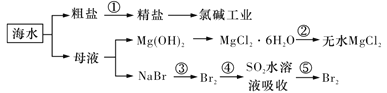
A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2 SO2
SO2 SO3
SO3 H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
-
下列与化工生产相关描述不合理的是
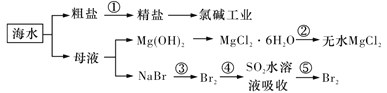
A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
B.在上图海水的综合利用中 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2 SO2
SO2 SO3
SO3 H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅

几种难溶电解质的溶度积(25℃):
精制除杂阶段的滤渣为MgCO3、______
写化学式
用HCl调pH为4~5的目的是_________。
二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
填序号
中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
沉锂温度需控制在
,主要原因是______。
碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。














