-
合成氨是人类科学技术发展史上的一项重大突破,2018年是合成氨工业先驱哈伯(P·Haber)获得诺贝尔奖100周年
(1)合成氨反应是一个可逆反应:N2(g)+3H2(g) 2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
(2)研究表明,在Fe催化剂作用下合成氨的反应历程为(*表示吸附态):
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;NH*+H*
NH*;NH*+H* NH2*;NH2*+H*
NH2*;NH2*+H* NH3*
NH3*
脱 附:NH3* NH3(g)
NH3(g)
其中,N2的吸附分解反应速率慢,解决了合成氨的整体反应速率。
实际生产中,合成氨常用工艺条件:Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8。请回答:
①分析说明原料中N2过量的理由____________。
②近年来,中国科学院大连化学物理研究所陈平研究团队经过近二十年的积累,先后在催化剂分解、催化氨合成、化学链合成氨等方面取得重要进展。关于合成氨工艺的下列理解,正确的是______。
A.人们对合成氨研究的重要目的之一是要实现氨的低温高效合成
B.控制温度(773K)远于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.陈平团队首次报道了具有优异低温活性的LiH-3d过渡金属这一复合催化剂体系,它可以大大提高反应的平衡转化率
D.N2的吸附分解反应活化能高,是合成氨反应条件苛刻的重要原因
E.陈平团队构建了一条基于可再生能源的化学链合成氨工艺流程,可以显著提高能效
(3)若N2和H2生成NH3的反应为: N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g),的标准平衡常数
NH3(g),的标准平衡常数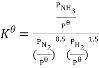 ,其中
,其中 为标准大气压(1×105Pa),
为标准大气压(1×105Pa), 、
、 和
和 为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
①N2和H2起始物质的量之比为1:3,反应在恒定温度和标准压强下进行,NH3的平衡产率为 ,则
,则 _________(用含
_________(用含 的最简式表示)
的最简式表示)
②根据合成氨反应的特点,标准平衡常数 随温度T升高而逐渐______(填“增大”或“减小”)。
随温度T升高而逐渐______(填“增大”或“减小”)。
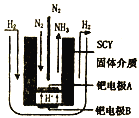
(4)希腊两位科学家曾经采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶体薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为______极(填“阴”或“阳”),该极上的电极反应式是___________。
-
课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g)  2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率为______________。
,则N2的转化率为______________。
(3)工业上合成氨的部分工艺流程如下:
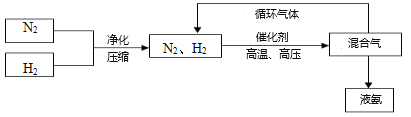
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
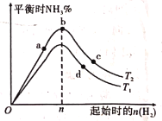
①图象中T2和T1的关系是:T2_______T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=_______________。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g)  2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g)  2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g) 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________。
-
化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
-
在科学史上每一次重大的发现都极大地推进了科学的发展。我国宁波藉科学家屠呦呦获得诺贝尔生理学或医学奖,她成为首获科学类诺贝尔奖的中国本土科学家。她获奖的原因是发现了
A.青蒿素 B.合成氨的生产工艺
C.提示了燃烧的本质 D.维生素
-
合成氨是人类科学技术上的一项重大突破,其反应原理为: △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
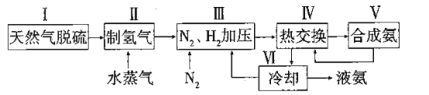
(1)步骤II中制氯气原理如下:
I. △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II. △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
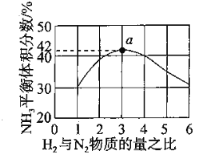
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2 (g) + 3H2 (g)  2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
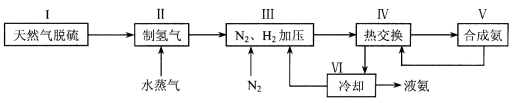
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(2)步骤Ⅱ中制氢气原理如下:
① CH4 (g) + H2O (g)  CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
② CO (g) + H2O (g)  CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
写出氢气和二氧化碳气体反应生成甲烷和水蒸气的热化学方程式 。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) 。
(4)用氨气制取尿素[CO(NH2)2]的反应为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH<0
CO(NH2)2(l)+H2O(g) ΔH<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。若保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应(0~70s)的进程曲线。

(5)25℃时,向a mol NH4NO3固体中滴加b L氨水后溶液恰好呈中性,所滴加氨水的浓度为 mol·L-1(25℃时,NH3·H2O的电离平衡常数Kb=2×10-5)
-
合成氨是人类科学技术发展史上的一项重大突破.合成氨反应的化学方程式为N2(g)+3H 2(g)==2NH3(g).一定条件下,在容积固定的密闭容器中反应达平衡后,请回答
(1)若增大N2 的浓度,则化学反应速率_______(填“增大”或“减小”),化学平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动.
(2)若加入适当的催化剂,则化学反应速率_______(填“增大”或“减小”),化学平衡_____(填“向正反应方向”、“向逆反应方向”或“不”)移动.
(3)若增大NH3 的浓度,则化学反应速率_______(填“增大”或“减小”),化学平衡_______(填“向正反应方向”、“向逆反应方向”或“不”)移动.
-
(18分)合成氨是人类科学技术上的一项重大突破。工业上以天然气为原料合成氨。其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如下图1所示。反应中处于平衡状态的时间为 、 ;10 min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4) α乙(CH4);

(2)转化阶段发生的可逆反应为: CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)  2NH3(g) ∆H=-92.4kJ•mol ‾1
2NH3(g) ∆H=-92.4kJ•mol ‾1
①依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。

(4)工业合成氨的热化学方程式为
N2(g)+3H2(g)  2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
-
(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
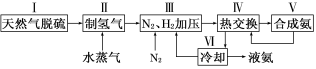
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量 。(填“变大”“变小”或“不变”)
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变), 混合气体的平均相对分子质量 。(填“变大”“变小”或“不变”)
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是_____。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为_____________。上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)__________。简述本流程中提高合成氨原料总转化率的方法:_____________________________________。
-
合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨。其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.1 kJ/mol
CO(g)+3H2(g) ΔH=+206.1 kJ/mol
①在一个密闭容器中进行上述反应, 测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是 。
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)
α乙(CH4)

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g) CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是 (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g) 2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
2NH3(g) ∆H=-92.4kJ/mol,根据勒夏特列原理,简述提高合成氨原料转化率的一种方法 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为_________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量__________(填“>”“<”或“=”)92.4 kJ。
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是____________
a.v(N2)=3v(NH3)
b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变
d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
2NH3(g),已知298K时:ΔH=-92.2kJ/mol,ΔS=-198.2J/(K·mol),则根据正反应的焓变和熵变分析,常温下合成氨反应____(填“能”或“不能”)自发进行。实验研究表明,在特定条件下,合成氨反应的速率与参加反应的物质的浓度的关系式如下,v=kc(N2)c1.5(H2)c-1(NH3),k为速率常数,请根据该关系式分析,如果想增大合成氨反应的速率,从浓度的角度可以采用的措施为________。根据合成氨反应的特点,请再说出一项能够提高合成氨反应速率的措施_________。
NH*;NH*+H*
NH2*;NH2*+H*
NH3*
NH3(g)
N2(g)+
H2(g)
NH3(g),的标准平衡常数
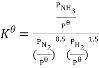 ,其中
,其中为标准大气压(1×105Pa),
、
和
为各组分的平衡分压,如P(NH3)=x(NH3) P,P为平衡总压,x(NH3)为平衡系统中NH3的物质的量分数。
,则
_________(用含
的最简式表示)
随温度T升高而逐渐______(填“增大”或“减小”)。









