-
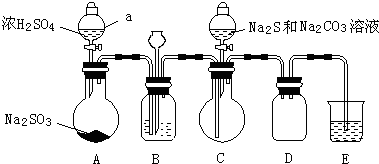
实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体;可溶于水。
(1)制备Na2S2O5(夹持装置略)
① A为SO2发生装置,A中反应方程式是_____________________________________。
② B 中析出白色晶体,可采取的分离方法是___________________。
③ 将尾气处理装置C补充完整并标明所用试剂。___________________
(2) 探究Na2S2O5的性质
| 实验编号 | 实验操作及现象 |
| 实验Ⅰ | 取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性。 |
| 实验Ⅱ | 取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解。 |
| 实验III | 取B中少量白色晶体于试管中,滴加1mL 2 mol / L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 。 |
| 实验IV | 取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复。 |
① 由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因_______________________________________(用化学方程式表示) 。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,用平衡原理解释原因______________________。
③ 实验III中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________。
④ 实验IV 中产生的气体为____________,实验中利用该气体的_________ 性质进行检验。
⑤ 从上述实验探究中,体现出Na2S2O5具有 _____________________性质。 ( 至少说出两点 )。
-
焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等。
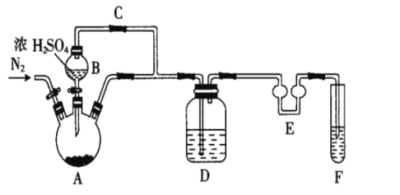
(1)制备Na2S2O5,如图(夹持及加热装置略)
可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体(试剂不重复使用)
焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(l)
①F中盛装的试剂是__,作用是__。
②通入N2的作用是__。
③Na2S2O5晶体在__(填“A”或“D”或“F”)中得到,再经离心分离,干燥后可得纯净的样品。
④若撤去E,则可能发生__。
(2)设计实验探究Na2S2O5的性质,完成表中填空:
| 预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 |
| 探究一 | Na2S2O5的溶液呈酸性 | ① |
| 探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1mL2mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
①__。(提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为__(KMnO4→Mn2+)
(3)利用碘量法可测定Na2S2O5样品中+4价硫的含量。
实验方案:将agNa2S2O5样品放入碘量瓶(带磨口塞的锥形瓶)中,加入过量c1mol·L-1的碘溶液,再加入适量的冰醋酸和蒸馏水,充分反应一段时间,加入淀粉溶液,__(填实验步骤),当溶液由蓝色恰好变成无色,且半分钟内溶液不恢复原色,则停止滴定操作重复以上步骤两次记录数据。(实验中必须使用的试剂有c2mol·L-1的标准Na2S2O3溶液;已知:2Na2S2O3+I2=Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)]利用Na2S2O5和FeSO4·7H2O先后分两个阶段处理含Cr2O72-的废水,先将废水中Cr2O72-全部还原为Cr3+,将Cr3+全部转化为Cr(OH)3而除去,需调节溶液的pH范围为___。
{已知:Ksp[Cr(OH)3]=6.4×10-31,lg2≈0.3,c(Cr3+)<1.0×10-5mol·L-1时视为完全沉淀}
-
焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
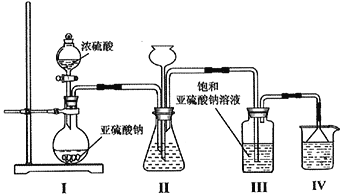
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
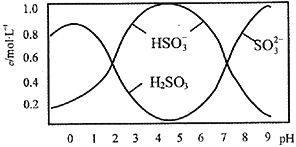
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
-
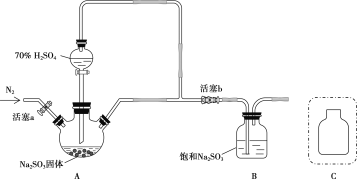
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2 的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
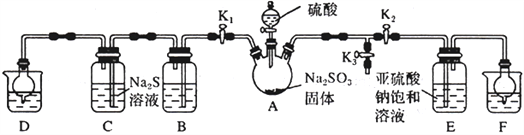
(1)向A 中滴加的硫酸最好选用__________________(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E 中有Na2S2O5晶体析出,装置E 中发生反应的化学方程式为__________________________。
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有__________溶液;若探究SO2的还原性,B 中发生反应的离子方程式可以是_____________________________________;观察到装置C 中发生的现象是__________________________。
(5)装置D和F 的作用为__________________________。
(6)设计实验验证Na2S2O5晶体在空气中已被氧化:__________________________。
(7)请指出该设计的缺陷:__________________________。
-
(15分)资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3。
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
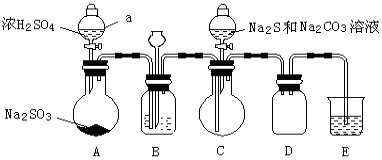
实验制备装置如下图所示(省略夹持装置):
回答问题:
(1)仪器a的名称是 。
(2)装置A中发生反应的化学方程式是 。
(3)装置B的作用之一是观察SO2的生成速率。
①B中最好盛装的液体是 。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是_________。
(4)在装置C中生成Na2S2O3。
①完成反应方程式: SO2 + Na2S + Na2CO3 = Na2S2O3 +
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是 。
③结束反应后,取C中溶液,经________、结晶、过滤、洗涤、干燥、得到Na2S2O3·5H2O。
(5)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S Na2CO3 Na2SO4 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生。 ④向滤液滴加2滴淀粉溶液,再逐滴加0.100 0 mol·L-1碘的标准溶液,至溶液呈紫色不再褪去,消耗碘的标准溶液体积为18.10mL。 | 产品杂质中: 一定含有 , 可能含有 , 一定不含有 。 操作④发生的反应是: 2S2O32-+I2===S4O +2I- +2I- 产品纯度: 。 |
-
资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。b.SO2、Na2S、Na2CO3反应可生成Na2S2O3。
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
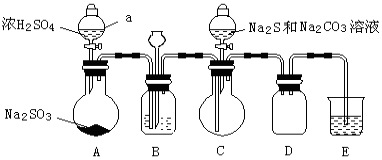
实验制备装置如下图所示(省略夹持装置):
回答问题:
(1)仪器a的名称是 。
(2)装置B中的长颈漏斗的作用是
(3)在装置C中生成Na2S2O3。
①完成反应方程式: SO2 + Na2S + Na2CO3 = Na2S2O3 +
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是 。
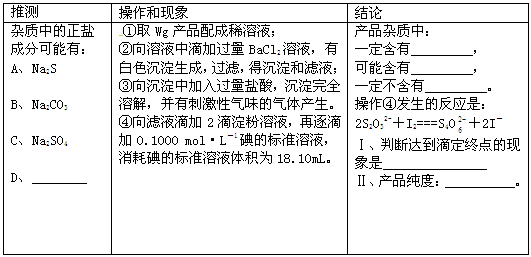
(4)完成对所得产品的检测的实验:
-
资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。
b.SO2、Na2SO3、Na2CO3反应可生成Na2S2O3。某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究。实验制备装置如图所示(省略夹持装置):
回答问题:
(1)装置A中发生反应的化学方程式是__________________;
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是____________________;
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是________________;
(3)在装置C中生成Na2S2O3.
①完成反应方程式:___SO2+_____ Na2S+_____Na2CO3=_____Na2S2O3+ _____
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是_______________;
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有:Na2S、Na2CO3、Na2SO4 及___________ | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液, 有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解, 并有刺激性气味的气体产生。 | 产品杂质中: 一定含有________ 可能含有________ 一定不含有_________ |
-
焦亚硫酸钠(Na2S2O5)是的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
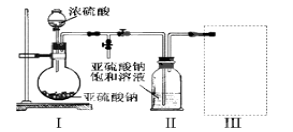
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。
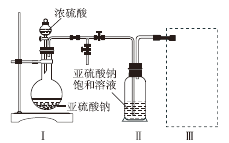
⑴ 装置Ⅰ中产生气体的化学方程式为________________________________;
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:__________________________;
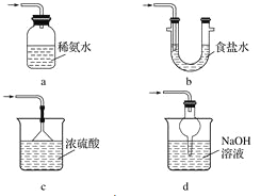
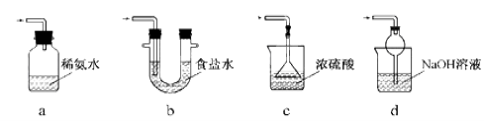
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为______________________________________;
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g·L-1。
-
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
[实验一 焦亚硫酸钠的制取]
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
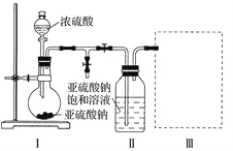
(1)装置Ⅰ中产生气体的化学方程式为____________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是____________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填字母)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________________。
-
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取:采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是
(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定
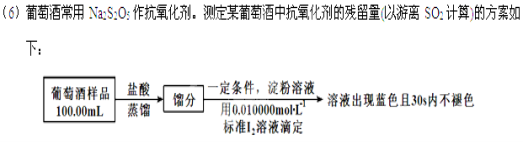
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。

















