-
高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
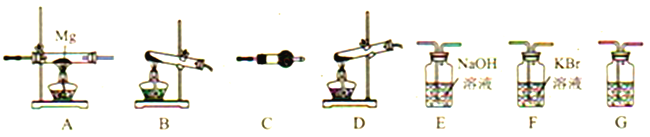
(1)写出高氯酸铵分解的化学方程式__________。
(2) 高氯酸铵分解选择的装置是__________ (填字母)。
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7) 某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

-
高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
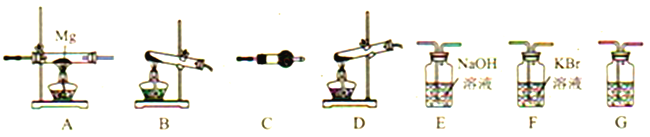
(1)写出高氯酸铵分解的化学方程式__________。
(2) 高氯酸铵分解选择的装置是__________ (填字母)。
(3)按气流从左到右,装置的连接顺序是: 分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7) 某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

-
高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。
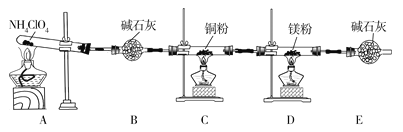
(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:
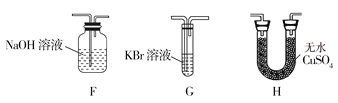
①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
-
高氯酸铵(NH4ClO4)为白色晶体,具有不稳定性,在400℃时开始分解产生多种气体,常用于生产火箭推进剂。某化学兴趣小组同学利用下列装置对NH4ClO4的分解产物进行探究。(假设装置内试剂均足量,部分夹持装置已省略)。

(1)在实验过程中发现C中铜粉由红色变为黑色,说明分解产物中有__(填化学式)。
(2)实验完毕后,取D中硬质玻璃管中的固体物质于试管中,滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体,产生该气体的化学方程式为__。
(3)通过上述实验现象的分析,某同学认为产物中还应有H2O,可能有Cl2。该同学认为可能有Cl2存在的理由是__。
(4)为了证明H2O和Cl2的存在,选择上述部分装置和下列提供的装置进行实验:

①按气流从左至右,装置的连接顺序为A→__→__→__。
②F中发生反应的离子方程式为__。
(5)实验结论:NH4ClO4分解时产生了上述几种物质,则高氯酸铵分解的化学方程式为___。
(6)在实验过程中仪器E中装有碱石灰的目的__;实验结束后,某同学拟通过称量D中镁粉质量的变化,计算高氯酸铵的分解率,会造成计算结果__(填“偏大”“偏小”或“无法判断”)。
-
高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
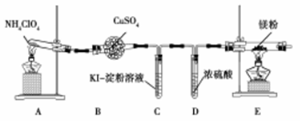
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
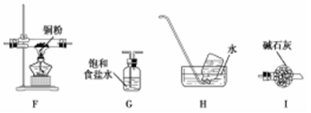
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
-
高氯酸铵(NH4ClO4)和铝粉常用作火箭推进剂的固体燃料。高温时,NH4ClO4的分解反应是:2NH4ClO4  N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
N2↑+4H2O↑+Cl2↑+2O2↑,下列有关NH4ClO4的分解及保存方法说法不合理的是
A.点燃铝粉可以引发NH4ClO4分解
B.NH4ClO4迅速分解时可能会引发爆炸
C.NH4ClO4应低温通风保存,远离火种、热源
D.0.5 mol NH4ClO4分解时产生的气体体积是44.8 L
-
高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
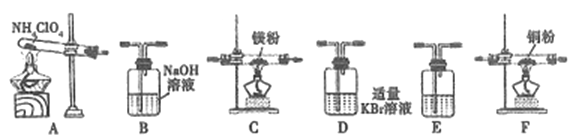
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:
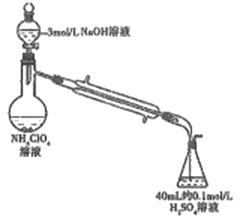
步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
-
高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
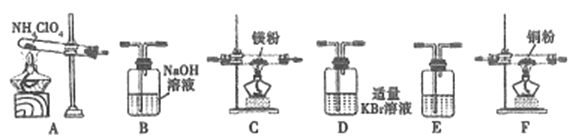
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:
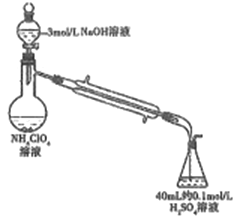
步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
-
高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:
已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。
(1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为________。
(2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。)
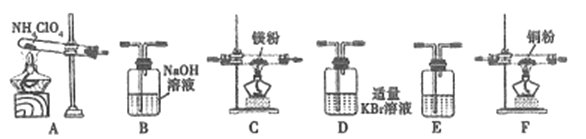
①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。
②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F装置,并用B~F字母填空)。
③证明产物中有Cl2的实验现象:________。
④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。
(3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下:
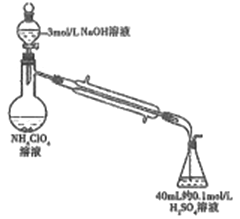
步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。
步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。
步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1 mL。
步骤6:重复实验2~3次。
回答下列问题:
①步骤2中,准确量取40.00ml H2SO4 溶液的玻璃仪器是: __________。
②为获得样品中NH4ClO4的含量,还需补充的实验是:______。
-
高氯酸铵(NH4ClO4)易分解产生大量气体,常用作火箭推进剂。实验室可通过下列反应制取:NaClO4(aq)+ NH4Cl (aq) NH4ClO4 (aq)+NaCl (aq)。
NH4ClO4 (aq)+NaCl (aq)。
(1)若 NH4Cl 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是_____。
(2)根据如图的溶解度曲线,在反应后得到的混合溶液中获得 NH4ClO4 晶体的实验操作依次为:_____,洗涤,干燥。
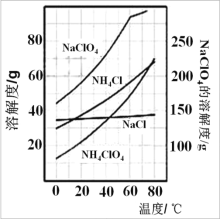
(3)在上述操作中,洗涤剂应选择_____
A. 热水 B. 乙醇 C. 冰水 D. 滤液
(4)样品中 NH4ClO4 的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),
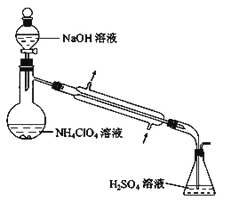
实验步骤如下:
步骤 1:按如图组装好仪器,准确称取样品 a g (约 0.5g) 于蒸馏烧瓶中,加入约 150mL 水溶解。
步骤 2:准确量取 40.00mL 约 0.1 mol·L-1H2SO4 溶液于锥形瓶中。
步骤 3:经滴液漏斗向蒸馏瓶中加入 20mL3mol•L-1NaOH 溶液。
步骤 4:加热蒸馏至蒸馏烧瓶中剩余约 100mL 溶液。
步骤 5:用新煮沸过的水冲洗冷凝装置 2~3 次,洗涤液并入锥形瓶中。
步骤 6:向锥形瓶中加入酸碱指示剂,用 c mol·L-1NaOH 标准溶液滴定至终点,记录消耗NaOH 标准溶液的体积。
步骤 7:将实验步骤 1-6 重复 2 次。记录消耗 NaOH 标准溶液的平均体积为 V1 mL
步骤 8:在步骤 1 中不加入样品,将实验步骤 1-6 重复 3 次。记录消耗 NaOH 标准溶液的 平均体积为 V2 mL。
请回答:
①步骤 2 中,准确量取 40.00mL H2SO4 溶液的玻璃仪器是_____。
②为确保氨气被充分吸收的实验步骤为_________,为提高氨的吸收率,本实验还缺少的一步实验的步骤为_____
③请用含字母的表达式表示(如果有数字,请化简成一个数字)样品中 NH4ClO4 的含量_____。

















