-
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的元素(不考虑稀有气体的原子半径);Y的单质呈黄色,常见于火山口附近。下列说法正确的是
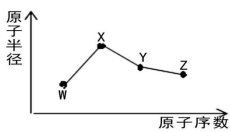
A. 氧化物的水化物酸性:Y<Z
B. 简单离子半径:W<X<Z
C. W的简单气态氢化物的沸点高于同族其它元素的简单气态氢化物
D. 将标况下等体积的Z单质与Y的低价氧化物同时通入品红溶液中,品红溶液迅速褪色
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1;在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。请回答下列问题:
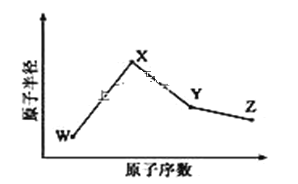
(1)X 元素位于元素周期表中位置为______。
(2)X 的单质和Y的单质相比,熔点较高的是_____(写化学式)。 Z 所在族的简单氢化物中,沸点最高的是____(写化学式),原因为______。
(3)W、X、Z 三种元素形成的化合物中化学键类型为_____;X2W2的电子式为____。
(4)Y 与 Z 形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为______。
(5)Z 的氧化物很多,其中一种黄绿色气体M,其氧含量为 47.41%,可用于水处理,M在液态和浓缩气态时具有爆炸性。M的化学式为______。M可与 NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为1︰5,该反应的化学方程式为________。
(6)在25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移 1mol 电子放热 190kJ,该反应的热化学方程式为_____。
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知 W 的一种核素的质量数为 18,中子数为 10;X 和 Ne 的核外电子数相差 1;在Z所在的周期中,Z 元素的原子得电子能力最强;四种元素的最外层电子数之和为18。请回答下列问题:
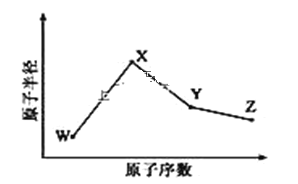
(1)X 元素位于元素周期表中位置为______。
(2)X 的单质和Y的单质相比,熔点较高的是_____(写化学式)。 Z 所在族的简单氢化物中,沸点最高的是____(写化学式),原因为______。
(3)W、X、Z 三种元素形成的化合物中化学键类型为_____;X2W2的电子式为____。
(4)Y 与 Z 形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为______。
(5)Z 的氧化物很多,其中一种黄绿色气体M,其氧含量为 47.41%,可用于水处理,M在液态和浓缩气态时具有爆炸性。M的化学式为______。M可与 NaOH溶液反应生成两种稳定的盐,它们的物质的量之比为1︰5,该反应的化学方程式为________。
(6)在25°C、101kPa 下,已知 Y 的简单气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移 1mol 电子放热 190kJ,该反应的热化学方程式为_____。
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是( )
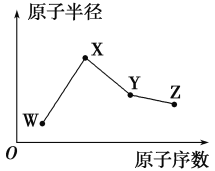
A.对应气态氢化物的稳定性:Y>W
B.对应简单离子的半径:W>Z
C.化合物XZW中既含离子键也含共价键
D.Y的氧化物能与Z的最高价氧化物对应的水化物反应
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
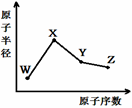
A.化合物XZW既含离子键也含共价键
B.对应气态氢化物的稳定性Y>Z
C.对应简单离子半径:X>W
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
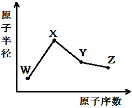
A.化合物XZW既含离子键也含共价键
B.对应气态氢化物的稳定性Y>Z
C.对应简单离子半径:X>W
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
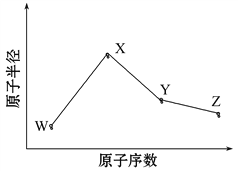
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有________个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是____________________________________________________。
(4)在25 ℃、101 kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是_________________________________________________________________。
-
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )
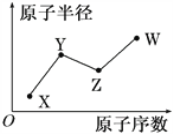
A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素
D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料。Z的非金属性在同周期元素中最强。下列说法正确的是
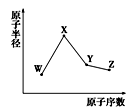
A. 对应简单离子半径:X>W
B. 对应气态氢化物的稳定性:Y>Z
C. 化合物XZW既含离子键,又含共价键,属于弱电解质
D. Y的氧化物和Z的氢化物均能与X的最高价氧化物对应的水化物反应
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )

A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应









