-
参考下列图表和有关要求回答问题:
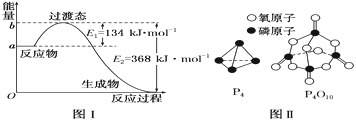
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________。
(3)下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能(kJ·mol-1) | 198 | 360 | 498 | x |
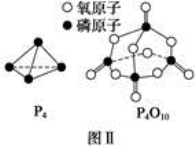
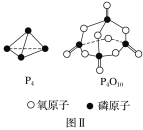
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
-
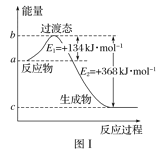
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
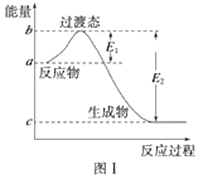
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
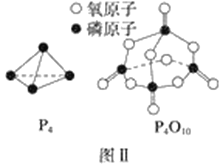
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
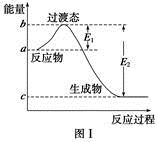
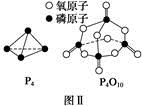
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式: 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,请参考题中图表,根据要求回答问题:
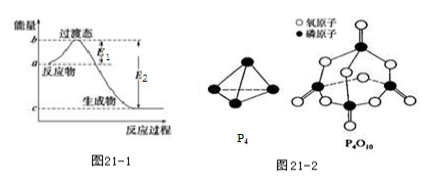
(1)图21-1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_____(填“增大”、“减小”或“不变”,下同),ΔH的变化是______。请写出NO2和CO反应的热化学方程式:______________。
(2)如下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O==O | P==O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为dkJ·mol-1,白磷及其完全燃烧的产物的结构如图21-2所示,则表中x=_________________kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
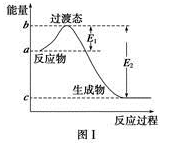
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
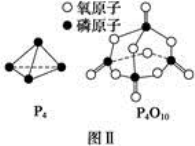
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
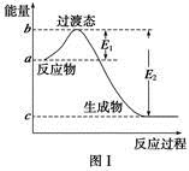
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
参考下列图表和有关要求回答问题:
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
-
甲醇被称为2l世纪的新型燃料。参考下列图表和有关要求回答问题:
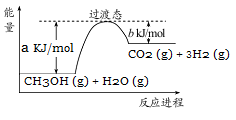
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。上图是该过程中能量变化示意图,请写反应进程CH3OH(g)和H2O(g)反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) △H=c kJ/mol
又知H2O(g) = H2O(l) △H=d kJ/mol。
则甲醇燃烧生成液态水的热化学方程式为 。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
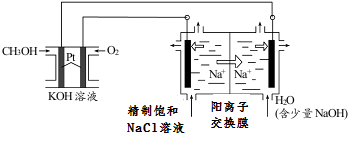
① CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH___________(填“增大”、“减小”、“不变”)。
② 图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为 。电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______________mol。
③用平衡移动原理解释图中电解池中阴极区pH增大的原因:
-
按要求回答问题:
(1)已知E1=134 kJ/mol、E2=368 kJ/mol,请参考题中图表,按要求填空:
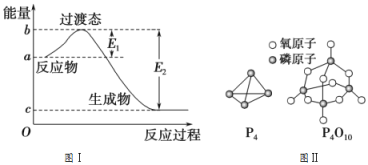
①图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是_______(填“增大”、“减小”或“不变”,下同),ΔH的变化是_______。NO2和CO反应的热化学方程式为:______________________________________________________________。
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ/mol) | a | b | c | x |
已知P4(g)+5O2(g)= P4O10(g) ΔH=-d kJ/mol,P4及P4O10的结构如图Ⅱ所示。表中x=___kJ/mol。(用含a、b、c、d的代数式表示)
(2)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是_______________________。
又知:H2O(g)=H2O(l)△H=-44 kJ/mol,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为__________kJ。
-
请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
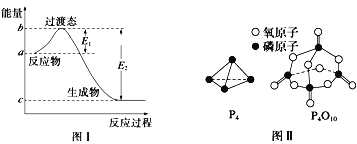
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___ (填“增大” 、“减小”或“不变”下同) ,△H的变化是________。请写出 NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为d kJ/ mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O 的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。

O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1














