-
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
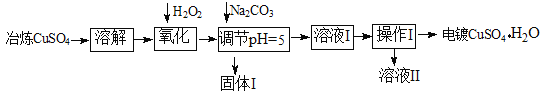
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为_____Kg。
(2)氧化步骤中发生的离子反应方程式为①___________
②AsO2— + H2O2+ H+=H3AsO4③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是____________________;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过___mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有_______________,操作I为_______________
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式_________
-
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
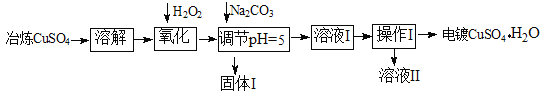
已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
-
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。
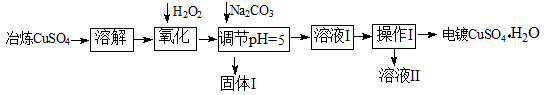
已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
-
利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:
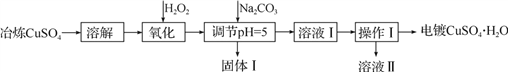
已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
-
利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:
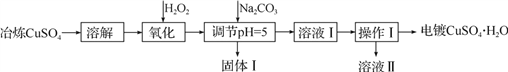
已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
-
利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:
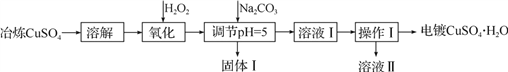
已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
-
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:
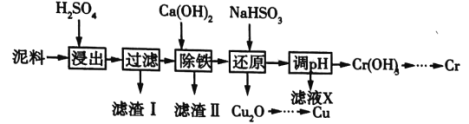
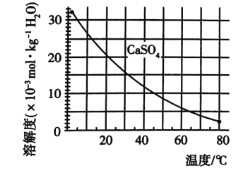
已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀 | 2.1 | 4.7 | 4.3 |
| 完全沉淀 | 3.2 | 6.7 | 5.6 |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。
-
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:

已知:
(1) 铬元素有以下循环过程:
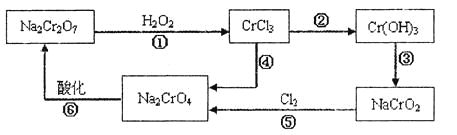
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
-
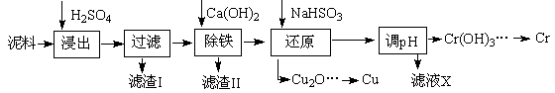
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
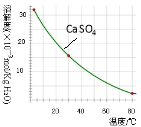
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31, )
)
-
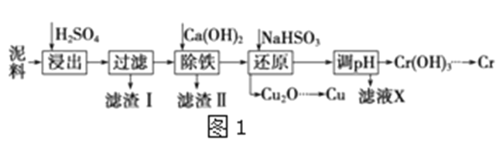
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
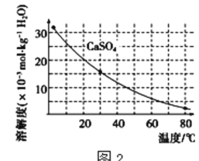
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__;
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到约__,检验Fe3+已经除尽的操作是__;②将浊液加到80℃,__;
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式__,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是__;
(4)在FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)•c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1mol•L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。













