-
利用电化学原理,将NO2、O2 和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示; 电解过程中溶液发生反应:Cr2O72-+ 6Fe2++ 14H+ = 2Cr3++ 6Fe3+ + 7H2O

(1)甲池工作时,NO2转变成绿色硝化剂Y,Y 是N2O5,可循环使用。则石墨II 是电池的____极;石墨Ⅰ附近发生的电极反应式为________________。
(2)工作时,甲池内的NO3-离子向__________极移动(填“石墨I”或“石墨II”); 在相同条件下,消耗的 O2和NO2的体积比为________________。
(3)乙池中Fe( I)棒上发生的电极反应为___________________。
(4)若溶液中减少了0.01mol Cr2O72-,则电路中至少转移了___________________mol 电子。
(5)向完全还原为Cr3+的乙池工 业废水中滴加NaOH 溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3 存在以下 溶解平衡:Cr(OH)3(s) = Cr3+(aq) + 3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c(OH-)=1.0 ×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH 应调至_____。比色卡对照即可。
-
利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
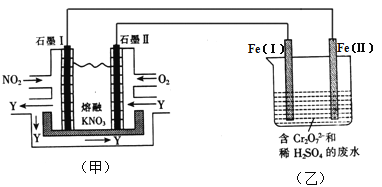
(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅱ是电池的____极;石墨Ⅰ附近发生的电极反应式为_______________。
(2)工作时,甲池内的NO3-离子向_________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为___________。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为_________________。
(4)若溶液中减少了0.01 mol Cr2O72-,则电路中至少转移了________mol电子。
(5)向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至____________。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至____________。
-
将NO2、O2和熔融KNO3制成燃料电池,电解处理含Cr2O72-的废水。电解过程中发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法正确的是( )

A.石墨Ⅱ是电池的负极
B.若溶液中减少了0.01molCr2O72-,则电路中至少转移了0.12mol电子
C.Fe(a)棒上发生的电极反应为:Fe-3e-=Fe3+
D.在相同条件下,消耗的O2和NO2的体积比为4∶1
-
下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是
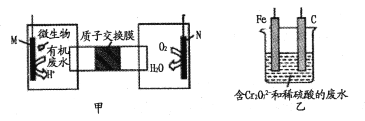
A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
-
工业上常用Fe作电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是

A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2CO32—
D.甲中阳极附近溶液中的离子反应方程式是: Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O
-
电化学在日常生活中用途广泛,如图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓。如图②是电解法除去工业废水中的Cr2O72-,下列说法正确的是( )
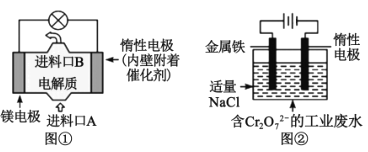
A.图①中镁电极发生的反应是:ClO-+H2O+2e-=Cl-+2OH-
B.图②最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-3e-=Fe3+
C.图②中每转移0.2mol电子,阴极逸出2.24LH2
D.若图①中7.2gMg溶解产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol
-
电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是电解法除去工业废水中的Cr2O72-.下列说法正确的是
A. 图②中Cr2O72-离子向铁电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②中阳极上的电极反应式为:Fe-3e-═Fe3+
C. 图①中发生的氧化反应是:ClO-+H2O+2e-═Cl-+2(OH)-
D. 若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可除去Cr2O72-的物质的量为0.05mol
-
【化学-化学与技术】
铬元素被人体吸收后具有致癌作用.某工业废水中含有Cr2O72-的酸性废水,可采用如下工艺处理:向废水中加入适量的NaCl,用Fe做电极进行电解,Cr2O72-还原为Cr3+然后生成Cr(OH)3沉淀除去.
(1)电解时加入适量NaCl的目的是______.
(2)电解时发生的电极反应为:阳极反应为______,阴极反应为______.
(3)Cr2O72-转化为Cr3+的原理是______.
(4)与Cr(OH)3同时生成的沉淀还有______(填化学式).
-
工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50 mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是( )
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨,滴加1 mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1 mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72- + 6e-+ 14H+ == 2Cr3+ + 7H2O
C. 实验③中,Cr2O72-去除率提高的原因是阳极产物还原Cr2O72-
D. 实验③中,理论上电路中每通过3 mol电子,则有0.5 mol Cr2O72- 被还原
-
工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原

Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至____________。





