-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。已知B元素L层电子数为K层上的2倍,D的原子核外存8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)写出D原子基态的价层电子排布图:________。
(2)下列说法错误的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:
B.电负性:
C. 与
与 互为等电子体,结构相似,化学性质相似
互为等电子体,结构相似,化学性质相似
D.稳定性: ,是因为水分子间存在氢键的缘故
,是因为水分子间存在氢键的缘故
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向元素F的硫酸盐溶液中通入过量的气体X(X由C、A两种元素形成的含有10个电子的微粒)可生成 ,该离子的结构式为____________(用相关元素符号表示)。
,该离子的结构式为____________(用相关元素符号表示)。
(4)某化合物与F(Ⅰ)(Ⅰ表示元素F的化合价为+1价)结合形成如图所示的离子,该离子中碳原子的杂化方式是_______。
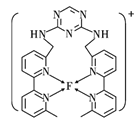
(5)已知 是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则
是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则 中σ键和π键的个数比为____。
中σ键和π键的个数比为____。
(6)C元素最高价含氧酸与硫酸酸性强度相近,原因是_______。
(7)B单质的一种同素异形体的晶胞如图所示:
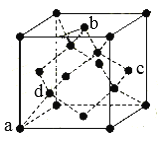
则一个晶胞中所含B原子个数为_____;其中原子坐标参数为: ,
, ,
, ,则c点原子的坐标参数为______。(坐标系如图)
,则c点原子的坐标参数为______。(坐标系如图)
(8)D与F形成离子个数比为1:1的化合物晶胞与 类似,D离子的配位数是________;设该晶胞的棱长为a pm,则该晶体的密度为________
类似,D离子的配位数是________;设该晶胞的棱长为a pm,则该晶体的密度为________ (用相关字母表示,已知阿伏加德罗常数为NA)
(用相关字母表示,已知阿伏加德罗常数为NA)
-
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
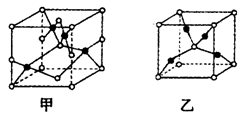
(4)已知D、E能形成晶胞如图所示的两种化合物,
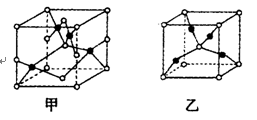
化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
-
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号),其原因为______。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
-
[化学—选修3:物质结构与性质](15分)已知A、B、C、D、E、F、G为前四周期七种元素且原子序数依次增大,其中A的基态原子中没有成对电子,B的基态原子中有6种不同运动状态的电子,C原子核外成对电子数比未成对电子数多1,其氢化物常用作制冷剂,D原子中有2个未成对电子,E基态原子在同周期中原子半径最大,F原子价电子排布为nsn-1nPn+1 ,G基态原子核外所有轨道都处于全满状态且属ds区的元素。
(1)G基态原子价电子排布式 ;
(2)B、C、D基态原子第一电离能由大到小的顺序 ;
(3)离子化合物CA5的晶体中含有的化学键有 ;
A.离子键
B.极性键
C.非极性键
D.配位键
E.金属键
(4)E2D的熔点比E2F的熔点 (填“高”或“低”),原因是 ;
(5)与BD2互为等电子体的分子有 (要求写一种)
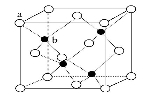
(6)GF在荧光体、光导体材料、涂料、颜料等行业中应用广泛。GF晶体结构如图所示,其晶胞边长为x pm,该晶体的密度为 g·cm-3(列式表示),a、b位置两粒子之间的距离为 pm(列式表示)(已知阿伏伽德罗常数为NA)
-
【化学——选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为___________________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号)。
(3)D元素与氟元素相比,电负性:D_______________F(填“>”、“=”或“<”)。
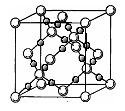
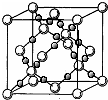
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于___________________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为_____________。l mol B2A2分子中含 键的数目是_________________。
键的数目是_________________。
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在____________。
a.共价键 b.配位键 c.σ键 d.π键
-
【化学--选修物质结构与性质】
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
(1)E元素基态原子的电子排布式为________.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________(填元素符号).
(3)D元素与氟元素相比,电负性:D________F(填“>”、“=”或“<”).
(4)BD2在高温高压下所形成的晶体其晶胞如图所示.该晶体的类型属于________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为________.l mol B2A2分子中含σ键的数目是________.
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]-生成,则[E(OH)4]-中存在________.
a.共价键 b.配位键 c.σ键 d.π键.
-
已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元索的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
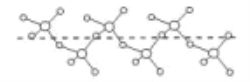
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______
(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
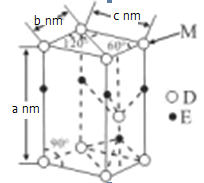
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
-
已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元素的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
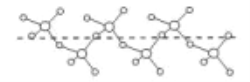
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______
(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
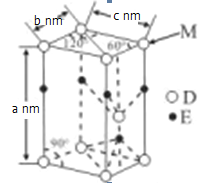
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
-
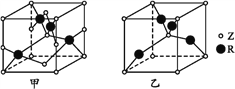
已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
-
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是内层电子数的3倍;E的+1价阳离子的核外有3层电子且各层均处于全满状态.
(1)E元素基态原子的核外电子排布式为 .
(2)B、C、D三种元素的第一电离能由小到大的顺序为 (填元素符号);
(3)B2A4是石油炼制的重要产物之一.B2A4分子中B原子轨道的杂化类型为 ;B2A4分子的空间构型是 ;1molB2A4分子中含σ键数目为 .












