-
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=﹣1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJ•mol-1
③H2O(g)=H2O(l) △H3=﹣44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
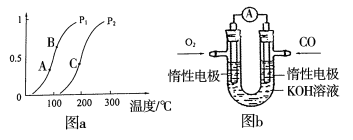
(2)工业上甲醇利用水煤气合成,反应为CO(g)+2H2(g)=CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
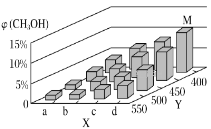
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点___(填“大”或“小”)。
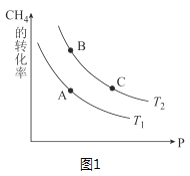
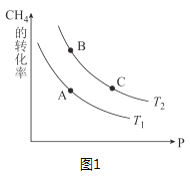
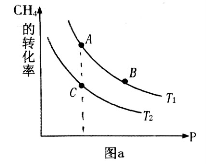
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H>0,一定条件下CH4的平衡转化率与温度、压强的关系如图1。则T1___T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为____。
(3)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2。
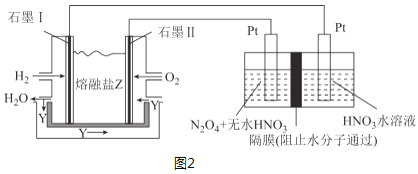
写出石墨Ⅰ电极上发生反应的电极反应式___。在电解池中生成N2O5的电极反应式为___。
-
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=﹣1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJ•mol-1
③H2O(g)=H2O(l) △H3=﹣44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)工业上甲醇利用水煤气合成,反应为CO(g)+2H2(g)=CH3OH(g) ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
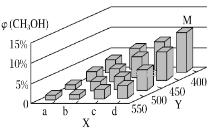
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点___(填“大”或“小”)。
③生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H>0,一定条件下CH4的平衡转化率与温度、压强的关系如图1。则T1___T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为____。
(3)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图2所示,其中Y为CO2。

写出石墨Ⅰ电极上发生反应的电极反应式___。在电解池中生成N2O5的电极反应式为___。
-
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① 2CH3OH(1) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = – 1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH2 = – 566.0 kJ/mol
③ H2O(g) = H2O(1) ΔH3 = – 44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则Tl ________T2(填“<”、“>”、“=”,下同);A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
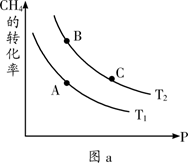

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =___________
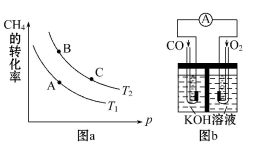
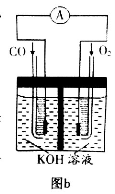
(3)某实验小组利用CO(g) 、 O2(g) 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为___________。
-
(15分)开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l)ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于: CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0
CO(g)+3H2(g)ΔH>0
①该反应的平衡常数表达式K= ,一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”“>”或“=”下同),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3v正(CH4)=v逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。当有4mol电子通过导线时,消耗标准状况下的O2体积为 L ,此时电解质溶液的PH值 (填“变大”、“变小”或“不变”)
-
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
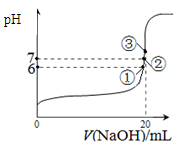
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
-
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
②100℃时,将1 mol CH4和2mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为50%,则100℃时该反应的平衡常数K = 。
(2)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH= 。(不考虑溶液体积的变化)
(3)已知2X2(g)+Y2(g)  2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_________Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_________Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
-
开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
 已知:①
已知:①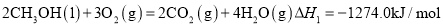
②
③ .
.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ______ .
 生产甲醇的原料CO和
生产甲醇的原料CO和 可由反应
可由反应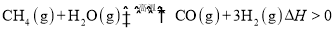 得到.
得到.
①一定条件下 的平衡转化率与温度、压强的关系如图
的平衡转化率与温度、压强的关系如图 则
则 ______
______  填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 、B、C三点处对应平衡常数
、B、C三点处对应平衡常数 、
、 、
、 的大小顺序为 ______ .
的大小顺序为 ______ .
② 时,将
时,将 和
和 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 ______  填序号
填序号 .
.
 .容器的压强恒定
.容器的压强恒定
 .容器内气体密度恒定
.容器内气体密度恒定
 正
正 逆
逆
 单位时间内消耗
单位时间内消耗 同时生成
同时生成
 甲醇燃料电池
甲醇燃料电池 简称
简称 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 ______ 极 填“正”或“负”
填“正”或“负” ,其电极反应式为 ______ .
,其电极反应式为 ______ .
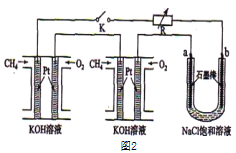
 某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为
某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为 闭合K后,若每个电池甲烷用量均为
闭合K后,若每个电池甲烷用量均为 标况
标况 ,且反应完全,则理论上通过电解池的电量为 ______
,且反应完全,则理论上通过电解池的电量为 ______  列式计算.法拉第常数
列式计算.法拉第常数 ,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
,若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 ______ .
-
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① =
= mol
mol
② =
= mol
mol
③ =
= mol
mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)生产甲醇的原料CO和H2来源于下列反应:

①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为 ;
)的大小关系为 ;
②100℃时,将1 mol  和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K= 。
的转化率为0.5,则100℃时该反应的平衡常数K= 。
(3)某实验小组利用CO(g)、 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
-
开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
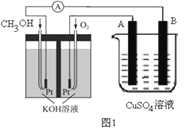
①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。
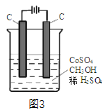
-
开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。

①写出燃料电池负极的电极反应式_________________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________L。
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________(法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____L(标准状况)。

(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________除去甲醇的离子方程式为______________________________。













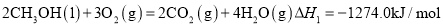
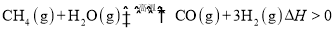 得到.
得到.







