-
研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
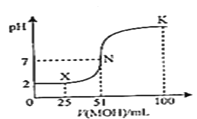
①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=______mol•L-1。
②常温下一定浓度的MA稀溶液的pH=a,则a__7(填“>”、“<”或“=”),用离子方程式表示其原因为_______________________________________;
③X点时,溶液中c(H+)、c(M+)、c(A—)由大到小的顺序是___________________;
④K点时,溶液中c(H+)+c(M+)—c(OH—)=____mol•L-1。
⑵20℃时,在c(H2C2O4)+c(HC2O4—)+c(C2O42—)=0.100mol•L—1的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。
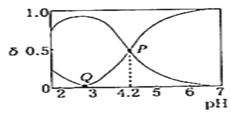
①Q点:c(H2C2O4)______c(HC2O4—)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=___________________。
-
常温下,向 100 mL 0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽
0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽 略不计)。回答下列问题:
略不计)。回答下列问题:
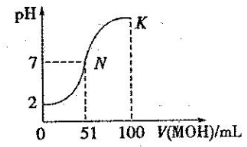
(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 。
(2)常温下一定浓度的MA稀溶液的pH = a,则a_________7(填“ > ”、“< ”或“=”),用离子方程式表示其原因:_____________________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:____________________。
(4)K点对应的溶液中,c(M+) +c(MOH)__________2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =_____________mol· L-1。
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________
(3)请写出K点所对应的溶液中离子浓度的大小关系______________________。
(4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
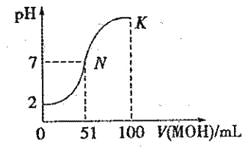
(1)由图中信息可知HA为__________酸(填“强”或“弱”),理由是______________。
(2)常温下一定浓度的MA稀溶液的pH = a,则a___7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)=______________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH)_____2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) =________mol· L-1。
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
-
常温下,用0.02mol•L-1MOH溶液滴定100mL0.01mol•L-1HA溶液,右图为加入MOH溶液的体积与混合溶液的pH变化情况(溶液体积变化勿略不计)。
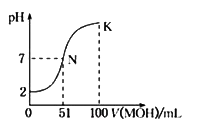
回答下列问题:
(1)由图中信息可知HA为_____酸(填“强”或“弱”),滴定所用的最适宜指示剂为______,滴定时眼睛注视__________________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_____7(填“大于”、“小于”或“等于”)此时,溶液中水电离出的c(OH-)=__________。
(3)请写出K点所对应的溶液中离子浓度的由大到小的关系:_______________。
(4)K点所对应的溶液中,c(M+)+c(MOH)______2c(A-)。(填“大于”“小于”“等于”)
(5)室温下MOH溶液加水稀释过程中,下列数值变小的是_______________(填序号)
①C(H+) ② C(H+)/ C(OH-) ③ C(OH-) ④ C(OH-)/ C(M+)
-
常温下,向 100 mL0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
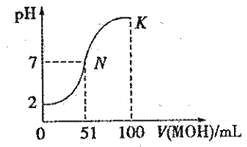
(1)由图中信息可知HA为_________酸(填“强”或“弱”),理由是________。
(2)常温下一定浓度的MA稀溶液的pH=a,则a_______7(填“>”、“<”或“=”),用离子方程式表示其原因:________________,此时,溶液中由水电离出的c(OH-)=_________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________________。
(4)K点对应的溶液中,c(M+)+c(MOH)__________2c(A-)(填“>”“<或“=”);若此时溶液的pH=10,则c(MOH)+c(OH-)=________mol·L-1。
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是

A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
-
常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述一定正确的是

A.由图中信息可知HA为弱酸
B.在N点pH=7,酸碱恰好完全反应
C.常温时一定浓度的MA稀溶液显中性
D.K 点对应的溶液中,c(M+) + c(MOH)=2c (A-)
-
常温下,向100mL0.01mol·L-1HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
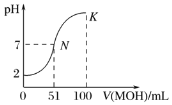
(1)由图中信息可知HA为________(填“强”或“弱”)酸,MOH为_________(填“强”或“弱”)碱。
(2)常温下一定浓度的MA稀溶液的pH=a,则a______(填“>”“<”或“=”)7,用离子方程式表示其原因:__________________,此时溶液中由水电离出的c(OH-)=____________。
(3)K点对应的溶液中,c(M+)+c(MOH)________(填“>”“<”或“=”)2c(A-),溶液中离子浓度的大小关系:__________________________。










