-
实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe ”的实验中检测到
”的实验中检测到 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的 硝酸银溶液(
硝酸银溶液( )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有 ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| I | 3 | 产生大量白色沉淀;溶液呈红色 |
| II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
| III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料:  -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生
假设b:空气中存在 发生反应
发生反应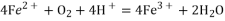 产生
产生
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b,c不是产生Fe3+的主要原因,并可证实假设d成立。
①实验:向硝酸酸化的__________溶液(  )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
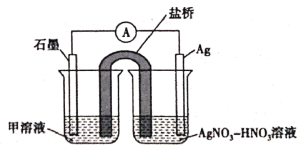
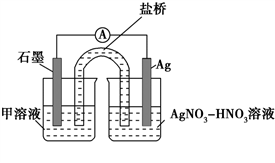
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
-
实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe ”的实验中检测到
”的实验中检测到 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的 硝酸银溶液(
硝酸银溶液( )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有 ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| I | 3 | 产生大量白色沉淀;溶液呈红色 |
| II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
| III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料:  -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生
假设b:空气中存在 发生反应
发生反应 产生
产生
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b,c不是产生Fe3+的主要原因,并可证实假设d成立。
①实验:向硝酸酸化的__________溶液(  )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
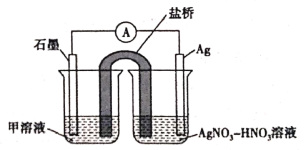
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
-
实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe ”的实验中检测到
”的实验中检测到 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的 硝酸银溶液(
硝酸银溶液( )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有 ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| I | 3 | 产生大量白色沉淀;溶液呈红色 |
| II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
| III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料:  -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生
假设b:空气中存在 发生反应
发生反应 产生
产生
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b,c不是产生Fe3+的主要原因,并可证实假设d成立。
①实验:向硝酸酸化的__________溶液(  )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
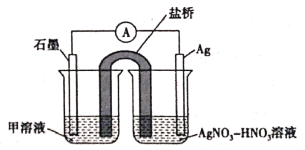
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
-
从宏观现象探究微观本质是重要的化学学科素养。以FeCl3溶液为实验研究对象,探究其与碱性物质之间的复杂多样性。实验如下:
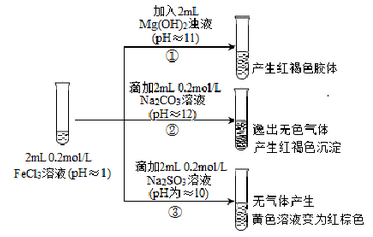
(1)①中反应的离子方程式是_________________。
(2)②中逸出的无色气体是_______________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
Ⅰ.甲取③中的红棕色溶液少许,滴入少量盐酸酸化的BaCl2溶液,产生白色沉淀。 甲得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是______________。
Ⅱ.乙认为甲的实验不严谨,重新设计并进行实验,证实了甲的结论是正确的。其实验方案是取Ⅰ中所得溶液少许进行__________离子的检验。
(4)受以上实验的启发,同学们对pH≈8的1mol/LNaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液。溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
Ⅰ.⑤的实验目的是___________。
Ⅱ.为探究④中溶液变无色的原因,进行如下实验:

资料显示:FeF3溶液为无色。
用平衡移动原理解释红褐色沉淀产生的原因:_______________。
(5)根据实验,FeCl3溶液与碱性物质之间的反应的多样性与_____________________有关。
-
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论: 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:
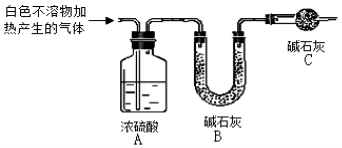
称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
-
某小组在验证反应“Fe + 2Ag+=Fe2+ + 2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①取少量黑色固体,洗涤后,____________________________________(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加__________溶液,产生蓝色沉淀,说明溶液中含有_____________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是________________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,白色沉淀:___________(化学式),且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| i | 3 | 产生大量白色沉淀;溶液呈红色 |
| ii | 30 | 产生白色沉淀较3min时量少;溶液红色较3min时加深 |
| iii | 120 | 产生白色沉淀较30min时量少;溶液红色较30min时变浅 |
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________________________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+_________________(用离子方程式表示)
假设d:根据加入KSCN溶液后产生白色现象,判断溶液中存在Ag+,可产生Fe3+。请写出产生Fe3+的离子方程式:______________________________。
③ 下列实验可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验:向硝酸酸化的__________溶液溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______________________________________________________________________________。
-
(16分)
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
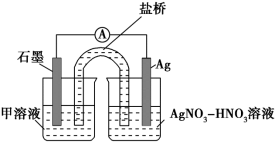
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
-
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
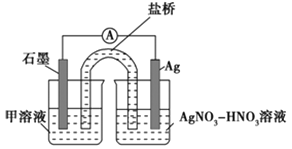
-
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:取出少量黑色固体,洗涤后,___(填操作和现象),证明黑色固体中含有Ag。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___(用离子方程式表示)。针对两种观点继续实验:

①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于___(用离子方程式表示),可氧化产生Fe3+;
假设c:酸性溶液中存在的___离子具有氧化性,可氧化产生Fe3+;
假设d:根据加入KSCN溶液后产生白色沉淀的现象,判断溶液中一定存在Ag+,Ag+可氧化Fe2+产生Fe3+。
③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的___溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:设计实验证明假设d成立___。
(3)根据ⅰ~ⅲ实验现象,结合本题涉及的三个方程式,推测实验ⅰ~ⅲ中Fe3+浓度变化的原因(用离子方程式和文字结合表述):___。
-
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
”的实验中检测到
发现和探究过程如下:向硝酸酸化的
硝酸银溶液(
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
乙认为铁粉过量时不可能有
,乙依据的原理是______。(用离子方程式表示)o
-生成白色沉淀AgSCN)
产生的原因做如下假设:
发生反应
产生
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。

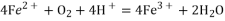 产生
产生







