-
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论: 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:
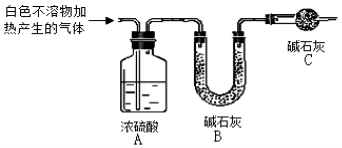
称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
-
(16分)某研究性学习小组探究碳化铝的性质:发现碳化铝与水在常温下剧烈反应,生成大量气体和白色沉淀,该沉淀既能溶于盐酸也能溶于NaOH溶液,该小组同学为了探究气体产物的组成,设计出如下实验:
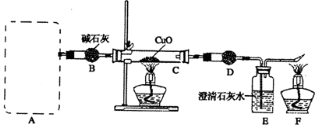
(1)利用碳化铝制取气体,下列装置中适合作为气体发生装置的是 。
(2)正确选择发生装置后,连接装置进行实验。一段时间后,硬质玻璃管C中黑色粉末变成红色,干燥管D中白色粉末变成蓝色,装置E中澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
①干燥管D中的试剂可能是 ,其作用是 。
②根据实验现象,某同学得出下列推论,其中正确的是 。
a.气体与氧化铜在一定条件下反应,氧化产物只有二氧化碳
b.气体与氧化铜在一定条件下反应,产物一定有水和二氧化碳,可能有一氧化碳
c.气体与氧化铜在一定条件下反应,产物一定有水、二氧化碳和一氧化碳
d.气体具有还原性,氧化产物可能有多种
(3)实验完毕后,要先后熄灭C和F处的酒精灯,应先熄灭的是 处酒精灯,理由是 。(只写出一条即可)
(4)若最后在F处点燃气体与在A处产生的气体相同,实验前系统内的空气已排尽,实验验结束后,C装置减轻12.8 g,D装置增重7.2 g,E装置增重8.8 g(假定D、E吸收气体是完全的),则A、C处发生反应的方程式分别为 、 。
(5)如图所示,U型透明玻璃管的左端封闭有A处产生气体和氯气的混合气,将该装置放在日光灯下。一段时间后(不考虑水与氯气的反应),下列关于U型管中可能出现的现象的叙述中正确的是( )
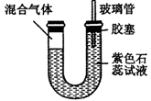
a.U型管左侧会有油状液滴出现
b.溶液很快变成蓝色
c.气柱缩小,右端液柱下降
d.气柱膨胀,右端玻璃管中液体溢出
-
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 ________
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧, 火焰呈淡蓝色 | 气体成分为 ________①________ |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量________②________ | ________③________ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ ________稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- 离子 |
实验Ⅲ中洗涤的操作方法是________。
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:
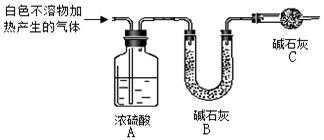
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
装置C的作用是 ________;
白色不溶物的化学式为 ________。
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式。
-
(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2•yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 ① |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32 -离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示:
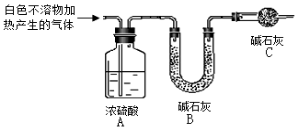
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是 ;
②白色不溶物的化学式为 。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
-
(15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2•yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 ① |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 ② | ③ | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示:
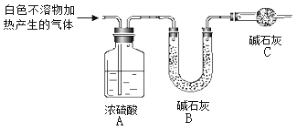
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是 ;
②白色不溶物的化学式为 。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
-
某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
甲同学:可能只是MgCO3;
乙同学:可能只是Mg(OH)2;
丙同学:可能是xMgCO3·yMg(OH)2
Ⅱ、定性实验探究:
(1)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则__________同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
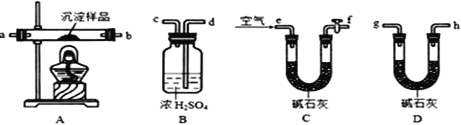
(2)实验中合理的连接顺序为:e→______→ → → → → g→h(各装置只使用一次)。
(3)实验一段时间后,当B装置中______________(填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是__________________,
(4)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值______(选填“偏大”、“偏小”或“无影响”)。
(5)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y=___________。(用含m、n的代数式表示)
-
某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
(1)甲同学:可能只是MgCO3;
乙同学:可能只是 ;
丙同学:可能是xMgCO3·yMg(OH)2
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方法是 。
Ⅱ、定性实验探究:
(3)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
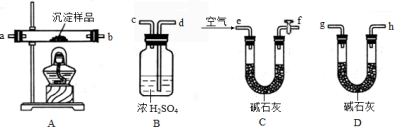
(4)实验中合理的连接顺序为:e→ → → → → → g→h(各装置只使用一次)。
(5)实验一段时间后,当B装置中 (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是 ,装置C中碱石灰的作用是 。
(6)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值 (选填“偏大”、“偏小”或“无影响”)。
(7)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y= 。(用含m、n的代数式表示)
-
某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
(1)甲同学:可能只是MgCO3;
乙同学:可能只是 ;
丙同学:可能是xMgCO3·yMg(OH)2
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方法是 。
Ⅱ、定性实验探究:
(3)取沉淀物少许于试管中,加入稀盐酸时固体溶解,产生大量气泡,则 同学假设错误(选填“甲”、“乙”或“丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:
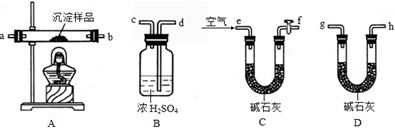
(4)实验中合理的连接顺序为:e→ → → → → → g→h(各装置只使用一次)。
(5)实验一段时间后,当B装置中 (填实验现象),停止加热,说明固体已分解完全;打开f处的活塞,缓缓通入空气数分钟的目的是 ,装置C中碱石灰的作用是 。
(6)指导老师认为在上述实验装置中末端还需再连接一个D装置,若无此装置,会使测出的x :y的值 (选填“偏大”、“偏小”或“无影响”)。
(7)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y= 。(用含m、n的代数式表示)
-
某化学实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中, 发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
I .提出假设:
(1)甲同学:可能只是MgCO3;
乙同学:可能只是______________;
丙同学:可能是:xMgCO3·yMg(OH)2。
(2)在探究沉淀成分前,需将沉淀从溶液中过滤、洗涤、低温干燥。洗涤沉淀的操作方法是____________________________________________________________。
(3)请设计一个简单的实验证明乙同学的假设是错误的_________________________。
Ⅱ.定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持装置未画出),经实验前后对比各装置的质量变化来分析沉淀样品的组成,得出丙同学的假设是正确的。请回答下列问题:
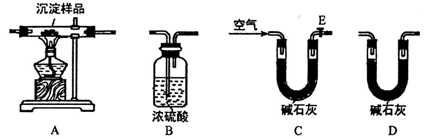
(4)写出xMgCO3·yMg(OH)2受热分解的化学方程式______________________。(用x、y表示)
(5)①合理的实验装置连接顺序为:_____→_____→_____→_____→。(各装置只使用一次)
② 实验一段时间后,当装置B中___________(填实验现象)时,停止加热,说明沉淀样品完全分解;然后打开E处的活塞,缓缓通入空气数分钟的目的是________________。
③指导老师认为在上述实验装置末端还需再连接一个装置D,若无此装置,.则会使测出的x∶y的值________________(填“偏大”、“偏小”或“无影响”)
-
某化学实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
I.提出假设:
(1)甲同学:可能只是MgCO3
乙同学:可能只是__________________
丙同学:可能是xMgCO3·yMg(OH)2
(2)在探究沉淀成分前,需将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方法是_________。
Ⅱ.定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定夹持装置未画出),经实验前后对比各装置的质量变化来分析沉淀样品的组成,得出丙同学的假设是正确的。请回答下列问题:
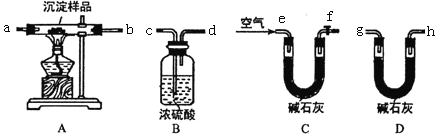
(3)写出xMgCO3·yMg(OH)2受热分解的化学方程式_________________________(用x、y 表示)
(4)①实验中合理的实验装置连接顺序为;e→____→_____→____→_____→____→_____→____(各装置只使用一次)___________________
②实验一段时间后,当装置B中_____________(填实验现象)时,停止加热,说明沉淀样品已完全分解,然后打开f处的活塞,缓缓通入空气数分钟的目的是_____________________________________。
③指导老师认为在上述实验装置末端还需再连接一个装置D,若无此装置,则会使测出的x∶y的值_______________(填“偏大”、“偏小”或“无影响”)
(5)若改进实验后,最终装置B 质量增加m 克,装置D质量增加n克,则x∶y=________(用含m、n 的代数式表示)

H+ + OH-、HCO3-
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。










