-
石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
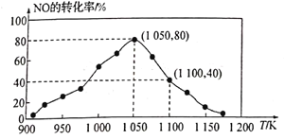
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
-
石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
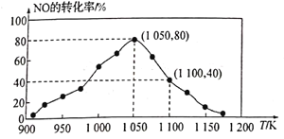
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,有人利用反应
C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =___________。
=___________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,有人利用反应
C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
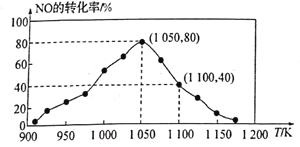
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =___________。
=___________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq) = NH4HSO3(aq) ΔH1=a kJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq) = (NH4)2SO3(aq)+H2O(l) ΔH2=b kJ·mol-1;
③2(NH4)2SO3(aq)+O2(g) = 2(NH4)2SO4(aq) ΔH3=c kJ·kJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l) 的ΔH=________kJ·mol-1
(2)燃煤发电厂常利用反应:2CaCO3(s)+2SO2(g)+O2(g) = 2CaSO4(s)+2CO2(g) ΔH=-681.8 kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)=________mol·L-1·min-1;当升高温度,该反应的平衡常数K________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙 B.通入一定量的O2
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时,CO2的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=________[已知:气体分压(P分)=气体总压(P总)×体积分数]。
(5)工业上常用高浓度的 K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图:
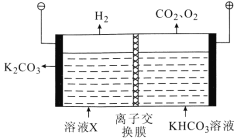
①在阳极区发生的反应包括___________和H++HCO3- =CO2↑+H2O
②简述CO32-在阴极区再生的原理:______________。
-
“绿水青山就是金山银山”,因此研究 、
、 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1) 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:
①
 ;
;
②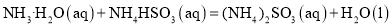
 ;
;
③
 。
。
则反应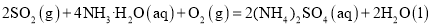 的
的 _____
_____
(2)燃煤发电厂常利用反应
 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
① 内,平均反应速率
内,平均反应速率 ________
________ ;当升高温度,该反应的平衡常数K________
;当升高温度,该反应的平衡常数K________ 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
② 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________ 填字母
填字母 。
。
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3) 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应


 ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
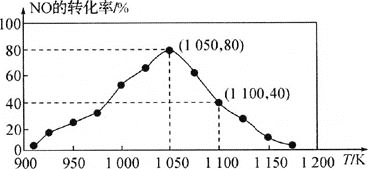
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;在1100K时, 的体积分数为________。
的体积分数为________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数 记作
记作 。在1050K、
。在1050K、 时,该反应的化学平衡常数
时,该反应的化学平衡常数 ________
________ 已知:气体分压
已知:气体分压 气体总压
气体总压 体积分数
体积分数 。
。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应


 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得, ,
, 、
、 为速率常数,只与温度有关
为速率常数,只与温度有关 。
。
①达到平衡后,仅升高温度, 增大的倍数________
增大的倍数________ 填“
填“ ”“
”“ ”或“
”或“ ”
” 增大的倍数。
增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为 ,则
,则 __________。
__________。
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)亚硝酰氯(Cl—N=O)气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为__。
相关化学键的键能如下表所示:
| 化学键 | Cl—Cl | N O(NO气体) O(NO气体) | Cl—N | N=O |
| 键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1;当升高温度,该反应的平衡常数K__(填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是__(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=__[已知:气体分压(P分)=气体总压(Pa)×体积分数]
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数_(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则 =__(计算结果用分数表示)
=__(计算结果用分数表示)
-
“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
0~10min内,平均反应速率υ(O2)__ mol·L-1·min-1;当升高温度,该反应的平衡常数K_____(填“增大”“减小”或“不变”)。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
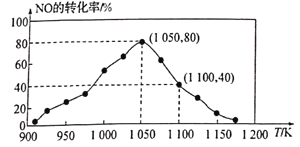
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为__________;在1100K时,CO2的体积分数为_____。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ [已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,υ正=k正·c2(NO)·c2(CO),υ逆=k逆·c(N2)c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =_____。
=_____。
-
经最新研究发现,NOx和SOx是形成雾霾天气的主要原因之一,因此研究NOx、SOx等大气污染物的妥善处理具有重要意义。
(1)为了消除NO造成的污染,通常采用一氧化碳和氢气进行催化还原NO。
已知:①N2(g)+O2(g)=2NO(g) ΔH=akJ•mol-1;
②2H2(g)+O2(g)=2H2O(l) ΔH=bkJ•mol-1;
③H2O(g)=H2O(l) ΔH=ckJ•mol-1。
写出H2与NO反应生成N2和水蒸气的热化学方程式:________________________。
(2)目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
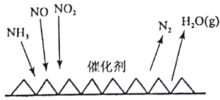
当NO2与NO的物质的量之比为1:1时,与足量氨气在一定条件下发生反应。当有12mol电子发生转移时,则参与反应的NO2的物质的量为________。
(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g) 2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)•c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) ΔH<0。实验测得:v正=v消耗(NO)=2v消耗(O2)=k正c2(NO)•c(O2),v逆=v消耗(NO2)=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
| 时间/ | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
| n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①从0~2s该反应的平均速率v(NO2)=________mol/(L•s)。
②T1温度时,上述反应的化学平衡常数K=________。
③若将容器的温度改变为T2时其k正=k逆,则T1________T2(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(4)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图。
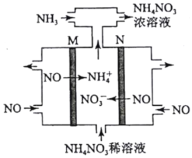
①N极的电极反应式为________________________。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为________。
-
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义。有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
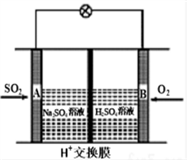
下列说法不正确的是
A. 溶液中H+的移动方向由A极到B极
B. 电池总反应方程式为:2SO2 + O2 + 2H2O = 2H2SO4
C. 正极电极反应式为:SO2+ 2H2O-2e=SO4 2+4H+
D. 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。





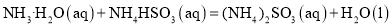
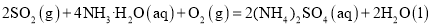 的
的




