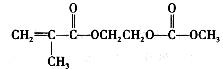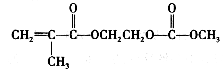-
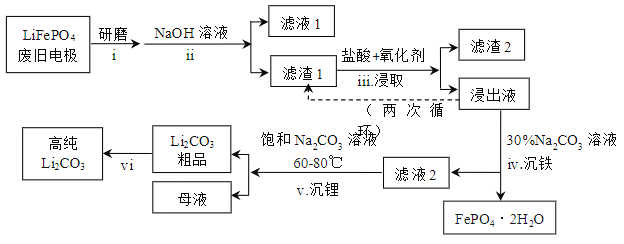
新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如下:
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是_______。
(2)过程ii加入足量NaOH溶液的作用是______。
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
| 序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | 滤渣中Li含量/% |
| 实验1 | HCl | H2O2 | 9.02 | 0.10 |
| 实验2 | HCl | NaClO3 | 9.05 | 0.08 |
| 实验3 | HCl | O2 | 7.05 | 0.93 |
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为______。
②结合实验结果和①中的现象,最终选择H2O2作为氧化剂,原因是______。
③过程iii得到的浸出液循环两次的目的是_____。
(4)浸出液中存在大量H2PO4−和HPO42−,已知:H2PO4− ⇌ HPO42− +H+,HPO42−⇌ PO43−+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因_____。
(5)对比过程iv和v,说明过程iv不用饱和Na2CO3溶液的原因______。
(6)简述过程vi的操作_______。
-
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。 磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
【方法一】 将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
【方法二】 将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
【方法三】 以铁红、锂辉石LiAl (SiO3)2 (含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
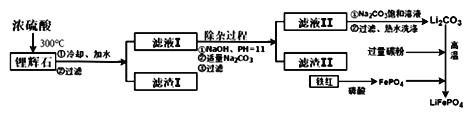
己知: 2LiAl (SiO3) 2+ H2SO4(浓)=Li2SO4+ Al2O3·4SiO2·H2O↓
| 溶解度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4) /g | 34.2 | 32.8 | 31.9 | 30.5 |
(1) 在方法一中,阳极生成磷酸亚铁锂的电极反应式为______________________________。
(2)在方法二中,除生成磷酸亚铁锂、乙酸外,还有H2O、________(填化学式)生成。
(3)方法一与方法二中,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是________________。
(4)在方法三中从滤渣I中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式________________。

(5)向滤液II中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是___________________________。(6) 写出在高温下生成磷酸亚铁锂的化学方程式______________________________________。
(7)磷酸铁锂锋动力电池(简称LFP) 是一种高效、超长寿命的二次电池。其工作原理为:
C6Li+FePO4 C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
C6Li(1-x)+ (1-x) FePO4+xLiFePO4充电时,写出阴极反应方程式____________________。
-
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
 方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

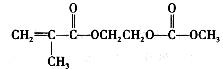
请回答下列问题:
 (1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是
。
 (2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、
、 (填化学式)生成。
 (3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
。
 (4)写出M与足量氧化钠溶液反应的化学方程式:
(4)写出M与足量氧化钠溶液反应的化学方程式:
。
 (5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
。
-
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
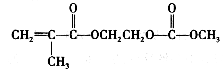
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外, 还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
-
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
-
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是______.
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有______、______、______(填化学式)生成.
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为______.
(4)写出M与足量氢氧化钠溶液反应的化学方程式:______.
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为______.
-
2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
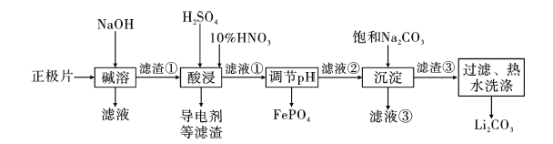
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
| T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
| 20 | 1.33 | 34.2 | 0.039 |
| 80 | 0.85 | 30.5 | —— |
| 100 | 0.72 | —— | |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L
-
2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
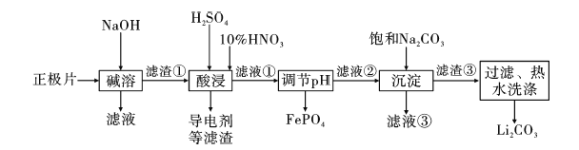
已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
| T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
| 20 | 1.33 | 34.2 | 0.039 |
| 80 | 0.85 | 30.5 | —— |
| 100 | 0.72 | —— | |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
-
2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
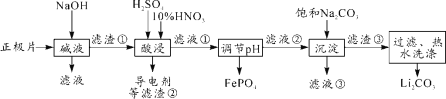
(1)从“正极”可以回收的金属有___________。
(2)“碱溶”时Al箔溶解的离子方程式_________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为______mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO32-)=________ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C  Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
① 实验中加入HgCl2饱和溶液的目的是__________。
② 磷酸亚铁锂电池中铁的含量为_______。
-
2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
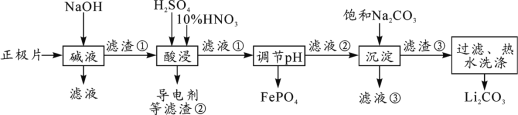
(1)从“正极”可以回收的金属有___________________。
(2)“碱溶”时Al箔溶解的离子方程式_________________________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为_________mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO )=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
)=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C  Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2= SnCl +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是________________________。
②磷酸亚铁锂电池中铁的含量为_______________。