-
第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“ ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
-
第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物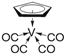 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“ ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
-
第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物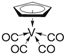 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“ ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
-
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体.下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
-
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于
Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是
A WX4是沼气的主要成分 B 固态X2Y是分子晶体
C ZW是原子晶体 D ZY2的水溶液俗称“水玻璃”
-
X是核外电子数最少的元素,Y是地壳中含量最多的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分
B.固态X2Y是分子晶体
C.ZW是原子晶体
D.ZY2的水溶液俗称“水玻璃”
-
75号元素铼,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰与铼处于同一族,锰原子价层电子的轨道表示式(价层电子排布图)为_______,它处于周期表的_____区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是___________________________。
②配位体NH3中N原子的杂化类型为_____,1mol 配离子[Cu(NH3)2]+中含有σ键的数目为______。
③写出与CO 互为等电子体的一种离子的化学式__________________。
(3)金属铼的熔点高于锰,试从原子结构的角度加以解释_________________________________________________。
(4)三氧化铼为立方晶胞,晶胞参数为3.74A(1A=10-10m),铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为_______,三氧化铼的密度为____g/cm3。(用NA表示阿伏加德罗常数的值,写计算式即可)
-
75号元素铼Re,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰原子价层电子的轨道表示式为__,锰处于周期表的__区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是__。
②醋酸根中C原子的杂化类型为__,1mol配离子[Cu(NH3)2]+中含有σ键的数目为__。
③写出与NH3互为等电子体的一种离子的化学式__。
(3)锰与铼处于同一族,金属铼的熔点高于锰,原因是___。
(4)三氧化铼为立方晶胞,晶胞参数为apm,三氧化铼的摩尔质量为Mg/mol;铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为__,铼原子填在了氧原子围成的空隙中___(填“四面体”“立方体”或“八面体”),三氧化铼的密度为__g/cm3。(用NA表示阿伏加德罗常数的值)
-
短周期元素A、B、C、D、E的原子序数依次增大,A是形成化合物种类最多的元素,C是短周期中金属性最强的元素,B、E同主族且B的原子序数是E的 ,D在地壳中的含量仅次于B。下列叙述正确的是( )
,D在地壳中的含量仅次于B。下列叙述正确的是( )
A. C与氧元素形成的化合物一定属于碱性氧化物
B. 最高价氧化物对应的水化物的酸性:E>D>A
C. 简单氢化物的沸点:E>B
D. 原子半径:C>D>E
-
铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料。化学上常用KSCN溶液等来检验溶液中是否存在Fe3+。
(1)Fe3+离子基态的电子排布式可表示为___。
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是___。
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为___。(填化学式)
(4)C、N、O三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(5)离子化合物Fe2O3的熔点高于KC1的熔点的原因是___。
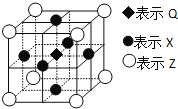
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q的原子的个数是___。
 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“”中的大π键可表示为__________。
 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“ 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“