-
已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1HCl溶液与0.2 mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A________B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH_____7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh=______mol/L
高二化学填空题困难题查看答案及解析
-
已知MOH为一元弱碱,25℃时,电离常数 Kb= 1×10- 6 mol·L-1,
(1)25℃时,将0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A________B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1 MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH ________ 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh=________mol/L
高二化学填空题困难题查看答案及解析
-
已知MOH为一元弱碱,25℃时,电离常数Kb=1×10- 6 mol·L-1。25℃时,0.01 mol·L-1 MOH溶液的pH=10,将其与等体积pH=4的盐酸溶液混合,则混合溶液的pH_____7(填“>”、“<”或“=”),试求此时溶液中MCl的水解平衡常数Kh=__________mol/L。
高二化学填空题简单题查看答案及解析
-
已知MOH为一元弱碱,25℃时,电离常数Kb=1×10- 6 mol·L-1。25℃时,0.01 mol·L-1 MOH溶液的pH=10,将其与等体积pH=4的盐酸溶液混合,则混合溶液的pH_____7(填“>”、“<”或“=”),试求此时溶液中MCl的水解平衡常数Kh=__________mol/L。
高二化学填空题简单题查看答案及解析
-
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是

A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-,因此溶液呈碱性
B. C点所在溶液中
=2.5×10-5
C. A、B、C、D四点溶液中,水电离出来的c(H+):C > D > B > A
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
高二化学选择题困难题查看答案及解析
-
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是

A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-,因此溶液呈碱性
B. C点所在溶液中
=2.5×10-5
C. A、B、C、D四点溶液中,水电离出来的c(H+):C > D > B > A
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
高二化学选择题困难题查看答案及解析
-
已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=
 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是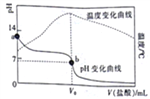
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
高二化学单选题困难题查看答案及解析
-
I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C.

(2)CH3COONH4的水溶液呈_______ (选填 酸性”、“中性"或“碱性”)。
(3)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当 Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5 mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得.上述反应的实验数据如下表。
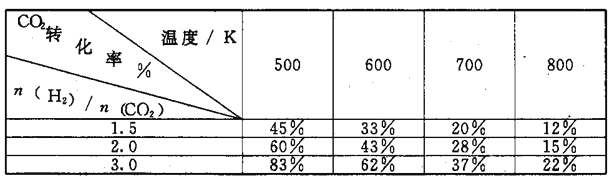
根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即
 ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
高二化学综合题中等难度题查看答案及解析
-
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
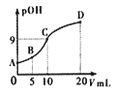
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
高二化学单选题困难题查看答案及解析
-
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
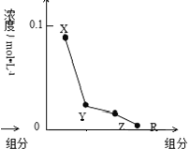
A.MOH的电离方程式:MOH=M++OH-
B.该混合液中水电离出来的c(H+)<10-7mol/L
C.该混合液中:c(R)+c(X)=c(Y)+c(Z)
D.图中c(X)+c(Z)=0.1mol/L
高二化学单选题中等难度题查看答案及解析