-
I.下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):

请回答下面问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是_____
A.c(H+) B.c(H+)·c(OH-) C. 
(2)CH3COONH4的水溶液呈_______ (选填 酸性”、“中性"或“碱性”)。
(3)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显酸性,通过计算说明其原因______。
(4)工业中常用碳酸镍制备氧化镍。已知:Ksp(NiCO3)=1.4×10-7,当 Ni,2+恰好完全转化为NiCO3沉淀[即溶液中c(Ni2+)=1×10-5 mol·L-1]时,溶液中c(CO32-)=_____mol/L。
II.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
CH3CH2OH (g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得.上述反应的实验数据如下表。
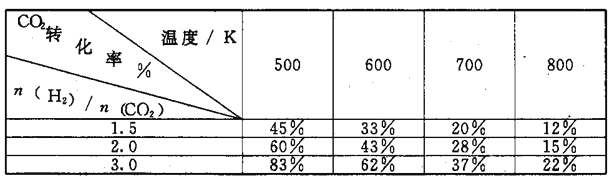
根据表中数据分析:
①上述反应的a_____0(填"大于”或“小于”)。
②在一定温度下.提高氢碳[即 ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示;

根据上图,写出反应的热化学方程式为____________。
-
下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | Ka=1.75×10-5 |
| 柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
| NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.
B.c(H+)
C.c(OH-)·c(H+)
D.
E.
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
-
描述弱电解质电离情况可以用电离度和电离平衡常数表示,常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),几种难(微)溶物的溶度积常数(Ksp)
| 酸或碱 | 电离平衡常数(Ka或Kb) | 难(微)溶物 | 溶度积常数(Ksp) |
| CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
| HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
| HCN | 5×10-10 | CaSO4 | 7×10-5 |
| NH3·H2O | 1.8×10-5 | CaCO3 | 5×10-9 |
请回答下列问题
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,电离常数不变_____(填字母序号)
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_______(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是____________________________。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的列排列为___________________________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2),具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3,现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mo1·L-1,则溶液中CO32-物质的量浓度应≥________________
-
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3∙H2O | 1.8×10-5 |
下表是常温下几种难(微)溶物的溶度积常数(Ksp):
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
请回答下列问题:
(l)写出HCN的电离方程式:___________,HClO的电子式__________。
(2)表中所给的四种酸中,酸性最强的是__________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大且电离常数改变的操作是__________(填字母序号)。
A.加少量冰酷酸 B.降低温度 C.加水稀释 D.升高温度 E.加少量的CH3COONa固体
(3)CH3COONH4的水溶液呈__________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是__________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BasO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.02 mol·L-1,则溶液中CO32-物质的量浓度应≥__________mol·L-1。
-
化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
-
化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
-
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
-
下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Kap)
| 表1 |
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HIO3 | 1.7×10-1 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 表2 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________mol·L-1。
-
化学平衡常数 、电离常数(Ka、Kb)、溶度积常数
、电离常数(Ka、Kb)、溶度积常数 等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A. 当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)和溶度积常数 一定均变大
一定均变大
B.  说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C. 向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生 沉淀,则
沉淀,则
D. 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
-
描述弱电解质电离情况可以用电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10﹣5 |
| HNO2 | 4.6×10﹣4 |
| HCN | 5×10﹣10 |
| HClO | 3×10﹣8 |
| NH3•H2O | 1.8×10﹣5 |
表2
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10﹣10 |
| BaCO3 | 2.6×10﹣9 |
| CaSO4 | 7×10﹣5 |
| CaCO3 | 5×10﹣9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是_____(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是___(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈_____(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系为_____。
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的顺序为_____。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L﹣1,则溶液中CO32-物质的量浓度最少应为_____。


CH3CH2OH (g)+3H2O(g) △H=a kJ/mol

 ]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。
]比,平衡常数K值_____(填“增大”、“减小”、或"不变”)。