-
高铁酸钾(K2FeO4)是一种绿色氧化剂,具有高效的杀菌消毒作用,常用于饮水处理,在许多领域展现出广阔的应用前景。制备高铁酸钾有下列两种方法:
方法一:Fe2O3 + KNO3 + KOH===== K2FeO4 + KNO2 + H2O (未配平)
方法二:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+ 5H2O
(1)配平方法一的化学方程式___,再用双线桥标明电子转移的方向和数目___:
___Fe2O3 +___KNO3 +___KOH == ___ K2FeO4 +___ KNO2 +___ H2O
(2)方法二中的还原产物为_________ (写化学式),将方法二的化学方程式改写为离子方程式 ________ ,根据反应方程式,氧化性:KClO ________ K2FeO4(填“>”、“<”或“=”);
(3)利用方法二制备K2FeO4,若有0.5mol K2FeO4生成,转移的电子数为___________ ;
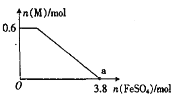
(4)在酸性溶液中,某反应的反应物和生成物有KBiO3、K2SO4、H2SO4、MnSO4、H2O、Bi2(SO4)3 和一种未知物质M。
①已知MnSO4在反应中失去电子,则该反应的氧化剂是________;
②已知该反应中被氧化的元素与被还原的元素的物质的量之比为2:5,则M的化学式为______;
③写出该反应的离子反应方程式________;
④某同学向上述反应后的溶液中逐滴加入FeSO4溶液,测得溶液中M的物质的量与FeSO4的物质的量之间的关系如图所示。已知氧化性:Fe3+>Bi3+,且a点时溶液中含Fe3+、Mn2+,则原反应体系中,起始加入的KBiO3的物质的量为____________。
-
Na2FeO4是一种高效多功能水处理剂,应用前景广阔,一种制备Na2FeO4的方法如下: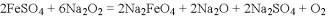 ,对此反应下列说法错误的是
,对此反应下列说法错误的是
A. Na2O2在反应中既是氧化剂也是还原剂
B. 1 mol FeSO4发生反应时,共有4mol电子转移
C. Na2FeO4既是氧化产物又是还原产物
D. O2是氧化产物
-
高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:
______Fe(OH)3+______ClO-+______OH-===______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。
①实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
②下列有关胶体的说法不正确的是________(填字母代号)。
a.光束通过Fe(OH)3胶体时形成光亮的“通路”
b.往Fe(OH)3胶体中加入稀硫酸,先出现红褐色沉淀,后沉淀溶解消失
c.Fe(OH)3胶体粒子不能透过滤纸,能透过半透膜
d.Fe(OH)3胶体发生电泳时,其胶体粒子向阴极移动
-
高铁酸钾(K2FeO4)是一种新型绿色消毒剂,其在消毒(发生氧化还原反应)后可形成Fe(OH)3胶体,常用于处理饮用水。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)干法制备高铁酸钾时,先制备得到Na2FeO4,反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中,氧化剂是________,氧化产物是________。
②每生成1 mol Na2FeO4,转移________mol电子。
(2)配平湿法制备高铁酸钾反应的离子方程式:______Fe(OH)3+______ClO-+______OH-=______FeO42-+______Cl-+______H2O
(3)取少量K2FeO4溶液,滴加盐酸,有Cl2产生,该反应表明氧化性:K2FeO4______(填“>”或“<”)Cl2。
(4)Fe(OH)3胶体可使水中悬浮物沉降下来,用作净水剂。实验室用饱和氯化铁溶液制取Fe(OH)3胶体的化学方程式是_____________________。
-
、Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2在反应中只作氧化剂
B. FeSO4在反应中作氧化剂
C. 2molFeSO4发生反应时,反应中共有8mol电子转移
D. Na2FeO4既是氧化产物又是还原产物
-
Na2FeO4是一种高效多功能水处理剂,应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2在反应中只作氧化剂
B.FeSO4在反应中作氧化剂
C.2molFeSO4发生反应时,反应中共有8mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
-
目前新一代高效、无污染的消毒剂二氧化氯(ClO2)已被许多国家广泛应用在饮用水的处理上。已知工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应关系为CH3OH+6NaClO3+3H2SO4=6ClO2+CO2+3Na2SO4+5H2O,则下列说法正确的是
A.氧化剂是甲醇
B.氧化剂与还原剂的物质的量之比为2∶1
C.氧化产物是二氧化氯
D.还原产物与氧化产物的物质的量之比为6∶1
-
目前新一代高效、无污染的消毒剂二氧化氯(ClO2)已被许多国家广泛应用在饮用水的处理上。已知工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应关系为CH3OH+6NaClO3+3H2SO4=6ClO2+CO2+3Na2SO4+5H2O,则下列说法正确的是
A.氧化剂是甲醇
B.氧化剂与还原剂的物质的量之比为2∶1
C.氧化产物是二氧化氯
D.还原产物与氧化产物的物质的量之比为6∶1
-
目前新一代高效、无污染的消毒剂二氧化氯(ClO2)已被许多国家广泛应用在饮用水的处理上。已知工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应,其反应关系为CH3OH+6NaClO3+3 H2SO4=6ClO2+CO2+3Na2SO4+5H2O,则下列说法正确的是( )
H2SO4=6ClO2+CO2+3Na2SO4+5H2O,则下列说法正确的是( )
A.氧化剂是甲醇 B.氧化剂与还原剂的物质的量之比为2∶1
C.氧化产物是二氧化氯 D.还原产物与氧化产物的物质的量之比为6∶1
-
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
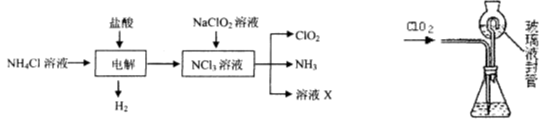
⑴ 写出电解时发生反应的化学方式: 。
⑵ 测定ClO2(如右图)的过程如下:在锥形瓶中加入足最的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
① ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为: 。
② 装置中玻璃液封管的作用是 、 。
③ 滴定至终点的现象是 。
④ 测得ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)

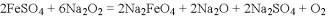 ,对此反应下列说法错误的是
,对此反应下列说法错误的是