-
CO和NO对环境影响较大,属于当今社会热点问题。请回答下列问题
(1)降低汽车尾气的反应:2NO(g)+2CO(g) N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________
(2)若在一定温度下,将1.4molNO、1.2molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示
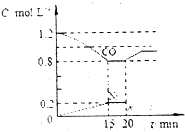
①该反应的平衡常数K=___________
②若保持温度不变,20min时再向容器中冲入CO、N2各0.8mol,平衡将向_______移动(填“向左”“向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能 是_______(填序号)
a.缩小容器体积 b.增加CO2的量 c.升高温度 d.加入催化剂
(3)固氮是科学家致力研究的重要课题,自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是______________。
| 反应 | 大气固氮 | 工业固氮 |
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| | | | | | |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.K越大说明合成氨反应的速率越大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.模拟大气固氮应用于工业上的意义不大
-
氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。回答下列问题:
(1)催化转化器可使汽车尾气反应而转化:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:2C(s)+O2(g)=2CO(g) ΔH1=akJ·mol-1;
C(s)+O2(g)=CO2(g) ΔH2=bkJ·mol-1;
N2(g)+O2(g)=2NO(g) ΔH3=ckJ·mol-1
ΔH=__kJ·mol-1(用含a、b、c的代数式表示);
(2)T℃时,将等物质的量的NO和CO充入容积为1L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。
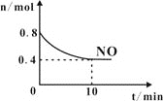
①T℃时,该化学反应的平衡常数K=___。
②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是___;
A.体系中NO的转化率和CO的转化率相等 B.气体的密度不再变化
C.NO消耗速率等于N2消耗速率的2倍 D.混合气体平均相对分子质量不再变化
③已知汽车尾气转化反应的ΔH<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是___。(填序号)
a.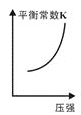 b.
b.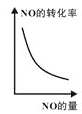 c.
c. d.
d.
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述不正确的是___(填标号)。
A.IO为反应的中间产物
B.第二步活化能比第三步小
C.第二步对总反应速率起决定作用
D.N2O分解反应中,k值与是否含碘蒸气无关
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___mol·L-1(用精确值表示);
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO2和N2,且物质的量之比为4:3,写出该方法的化学方程式___。
-
“霾”是当今世界环境热点话题。目前我国许多地方空气质量恶化原因之—是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1 (a>0)
(1)在一定温度下,将2.0 mol NO、2.4 mol CO气体通入到固定容积为2L的密闭容器中,
反应过程中部分物质的浓度变化如图所示:
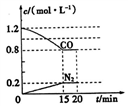
① 0〜15 min N2的平均速率v(N2)=_______;NO的转化率为 _______。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_______(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的溫度不变,20 min时再向容器中充入NO、N2各0.4mol,化学平衡将________移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为___________。
(2)已知:2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-l (b>0)CO的燃烧热△H=-ckJ·mol-l(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式为______________。
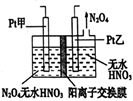
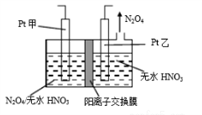
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_______极,电解池中生成N2O5的电极反应式是_________。
-
“霾”是当今世界环境热点话题。目前各地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)  2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
在一定温度下,将2.0 molNO、2.4 mol CO气体通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
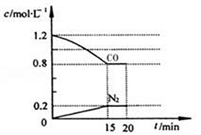
① 0〜15 min NO的转化率为_________。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将________(选填“向左”,“向右”或“不”)移动,重新达到平衡后,该反应的化学平衡数为_______________。
(2)己知: 2NO(g)+O2(g) =2NO2(g) △H=-bkJ·mol-1(b>0) ; CO的燃烧热 △H=-ckJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式________ 。
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_____极,电解池中生成N2O5的电极反应式是__________________。
-
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
-
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
-
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)  N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
A. 只要使用合理的催化剂及载体,就可完全清除NO和CO
B. 使用催化剂只能改变反应的速率不能改变反应的平衡常数
C. 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D. 恒温恒容条件下,通入惰性气体可提高NO转化率
-
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g) N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
A.该反应达到平衡时v(NO)正=v(CO)逆
B.只要使用合理的催化剂及载体,就可完全清除NO和CO
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.使用性能好的催化剂可使反应的平衡常数增大
-
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g) N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是( )
A.该反应达到平衡时v(NO)正=v(CO)逆
B.只要使用合理的催化剂及载体,就可完全清除NO和CO
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.使用性能好的催化剂可使反应的平衡常数增大
-
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现
2NO(g)+2CO(g) N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是
N2(g)+2CO2(g)的反应。关于该反应,下列说法正确的是
A.只要使用合理的催化剂及载体,就可完全清除NO和CO
B.使用催化剂只能改变反应的速率不能改变反应的平衡常数
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.恒容条件下,通入惰性气体可提高NO转化率
N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072 kJ/mol,CO2中C=O的键的键能为750 kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=___________


 b.
b. c.
c.



