-
甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题。
甲:用可溶性铝盐与稀氨水反应制取氢氧化铝。写出该反应的离子方程式: 。
乙:根据右图电解装置制取氢氧化铝。请回答:

(1) 电源中A极是 极,铝极的电极反应式为 ;
(2)从原理分析,电解质NaCl的作用是 。
丙:利用铝屑、稀H2SO4、NaOH溶液为主要原料制取Al(OH)3固体。
(1)先设计了如下三种方案:
Ⅰ Al3+→Al(OH)3
Ⅱ Al→AlO2-→Al(OH)3
Ⅲ 
从节省原料的角度分析,你认为最合理的方案是 。(填Ⅰ、Ⅱ或Ⅲ)
(2)设计了如下实验步骤:
①配制500 mL 0.5 mol•L-1NaOH溶液所用到的仪器有:托盘天平(含砝码)、烧杯、玻璃棒、 ;
②在烧杯A中加入50 mL 0.5 mol•L-1NaOH溶液,再加入足量铝屑给溶液稍加热。其作用是 ,用蒸馏水把铝屑冲洗,干燥后称其质量为m1 g(全部用于制氢氧化铝);
③在盛有适量稀H2SO4的烧杯B中放入 g(含m1的式子表示)铝屑,充分搅拌使铝屑反应完全;
④在盛有适量浓NaOH溶液的烧杯C中入一定质量的铝屑,充分搅拌使铝屑反应完全。该反应的化学方程式为 ;
⑤将烧杯B和烧杯C中的溶液混合,得到氢氧化铝白色沉淀;
⑥将沉淀过滤、洗涤、干燥得Al(OH)3固体m2 g。
试计算此实验中Al(OH)3的产率是 。
-
铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.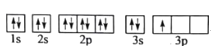
B.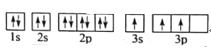
C.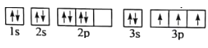
D.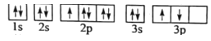
其中能量最低的是____(填字母),电子由状态C到状态B所得原子光谱为____光谱(填“发射”或“吸收”) ,状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合_____。
(2)熔融态氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
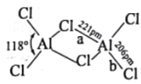
①a键的键能_____b键的键能(填“>”“<”或“=”),其理由是_______。
②Al2Cl6中铝原子的杂化方式为___;AlCl3的空间结构为______。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。
①冰晶石的化学式为_____,一个冰晶石晶胞中Na+的个数为_____。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=____pm(列出算式即可,阿伏加德罗常数值为6.02×1023)。
-
化学与人类社会生活密不可分,下列说法正确的是( )
A.用铝制器皿可长时间盛放酸性、碱性或咸的食物
B.用可溶性铝盐的溶液与过量氨水反应可制取Al(OH)3
C.用加热的方法可除去 NaHCO3固体中混有的少量Na2CO3
D.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液肯定是钠盐溶液
-
用氯化铝制取的纯净的硝酸铝的最佳方法是 ( )
A、用氯化铝与纯硝酸反应
B、用氯化铝溶液和硝酸钡溶液反应
C、用氯化铝溶液与氢氧化钠反应,过滤得沉淀再加纯HNO3
D、用氯化铝溶液与氨水反应,过滤得沉淀再加纯HNO3
-
下图为甲同学设计的制取并检验C2H4性质的实验装置图。请回答有关问题:

(1)写出上述制乙烯的反应的化学方程式: ,
(2)加入几片碎瓷片的目的是 ,
(3)加热时,使混合液温度迅速升高到170℃,是为了 ,
(4)实验过程观察到的现象为:
①Br2的四氯化碳溶液由 色变 ,
②酸性KMnO4溶液 。
(5)乙同学认为甲同学设计的实验如果仅从酸性KMnO4溶液褪色难以证明反应有乙烯生成,因为反应产生的乙烯中可能混有 气体也能使酸性KMnO4溶液褪色。写出此气体使酸性KMnO4溶液褪色的离子方程式 。
-
下列事实不能用勒夏特列原理解释的是
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
-
下列各项与化学平衡移动原理无关的是
A.加催化剂,使N2和H2在一定的条件下转化为NH3
B.收集氯气用排饱和食盐水的方法
C.加压条件下有利于SO2和O2反应生成SO3
D.可用浓氨水和氢氧化钠固体快速制取氨气
-
化学课外活动小组利用以下装置完成系列实验.请回答以下问题:

(1)装置甲中仪器a的名称为___ . 用装置甲制取NH3 , 在b中加入CaO固体,a中加入浓氨水,写出反应的化学方程式:___ .
(2)将C12持续通入装有淀粉一KI无色溶液的装置乙中,溶液变蓝而后逐渐褪色.查阅资料得知:溶液蓝色逐渐褪色,是因为有+5价的碘元素生成.请写出该反应的离子方程式:___ .
(3)用装置丙模拟“氨的催化氧化”实验.锥形瓶内装有浓氨水,通入空气,并将红热的铂丝插入锥形瓶内,铂丝保持红热.铂丝保持红热的原因是___;锥形瓶内还可观察到现象是___ .
(4)活动小组从“绿色化学”角度出发.在装置丁中进 行SO2的性质实验.其中棉花上蘸有不同试剂.请填写表中空白:
| 棉花位置 | ① | ② | ③ |
| 棉花上蘸有的试剂 | 品红溶液 | 酸性高锰酸钾溶液 | ___ |
| 现象 | ___ | 溶液紫色褪去 | 无 |
| 结论 | SO2具有漂白性 | SO2具有___ | SO2有毒,不能排空 |
-
下列事实不能用勒沙特列原理解释的是
A.用排饱和氯化钠溶液的方法收集氯气
B.加催化剂,在一定条件下使N2和H2转化为NH3
C.加压有利于SO2与O2反应生成SO3
D.可用浓氨水和氢氧化钠固体来快速制取氨气
-
工业上的许多反应工艺来源于实验室里的简单操作,比如用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下:
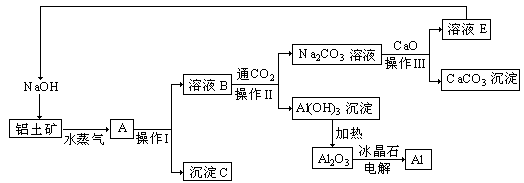
请回答下列问题:
(1)写出铝土矿中加入NaOH溶液的反应方程式 。
(2)沉淀C的颜色和一种用途分别为____ ___。
(3)操作I、操作II、操作III都用到的玻璃仪器是有________ ________。
(4)实验室洗涤Al(OH)3沉淀应该如何操作: 。
(5)整个生产过程中,除可以循环使用的物质有____ ____(任意两种,填化学式)。用此法铝的副产品是________(填化学式)。







