-
(14分)现有5种短周期元素A、B、C、D、E,原子序数依次增大。A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素。D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物。回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式 。
(2)CS2和B、D元素形成的一种化合物为等电子体,则CS2的分子结构为 ,1molCS2中含有的π键为 个。
(3)Y的中心原子的杂化轨道类型为 ,分子的立体构型为 。
(4)由A、B、D、E形成的化合物W、Z,其中W由三种元素组成,Z由四种元素组成,水溶液物显碱性,用离子方程式表示Z溶液显碱性的原因 。等浓度,等体积的W,Z的混合溶液中,离子浓度由大到小的顺序为 。
(5)有一种氮化钛晶体的晶胞如图所示,钛原子的电子排布式为 ,该氮化钛的化学式为 ,氮原子的配位数为 。晶胞中N、Ti之间的最近距离为apm,则氮化钛的密度为 g.cm3(NA为阿佛加德罗常数值,只列式计算)。

-
短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖相同。
(1)M位于元素周期表中第 周期 族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为 。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为 。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为 。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为 。
-
短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
-
短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
-
短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
-
(1)短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
①M在元素周期表中的位置是__________________________。
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为_____________。
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
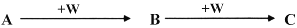
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为________________
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为_______________
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为__________ g,在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度________________0.1mol·L-1 (填“大于”“等于”或“小于”)。
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______________
-
短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
-
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且
M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是( )
A.X分别和其它四种元素均可形成至少2种化合物
B.M分别和W、X、Y、Z形成化合物,均显相同化合价
C.M、X、Z三种元素组成的化合物含有离子键
D.M、X、Y组成化合物和Y、Z组成化合物,其等物质的量浓度的水溶液中由水电离出的氢离子浓度相同
-
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是
A.X分别和其它四种元素均可形成至少2种化合物
B.M分别和W、X、Y、Z形成化合物,均显相同化合价
C.M、X、Z三种元素组成的化合物含有离子键
D.M、X、Y组成化合物和Y、Z组成化合物,其水溶液均呈碱性
-
短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖相同。
(1)M位于元素周期表中第_________周期_________族。
(2)化合物p由W、X、Y、M四种元素组成,已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)用X、Y、Z三种元素可组成可组成摩尔质量为84g·mol-1的q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中个原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式
为_________。