-
(15分)已知A、B、C、D、E、F、G七种元素原子序数均小于36,它们的核电荷数依次增大。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的基态电子排布中L能层有两个未成对电子,E和D同主族;F原子的基态电子排布中有4个未成对电子;G与F在周期表中同族,且G原子的外围电子排布中有2个未成对电子。根据以上信息填空:
(1) B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)
(2)F2+离子的价层电子排布图是 ,
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,E元素的氢化物的VSEPR模型为 。
(4)A和C形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物_____(填化学式);其中心原子C的杂化方式为 。
(5)化合物BD2、C2D和阴离子EBC-互为等电子体,它们结构相似,EBC-的电子式为 。F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为_______;
(6)GD的晶体结构与氯化钠相同,在晶胞中G离子的配位数是_______;已知晶胞的边长为a nm,晶体的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则晶体的密度为_________g·cm-3。
高二化学填空题极难题查看答案及解析
-
(10分)有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
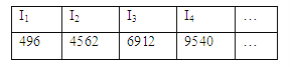
⑤E元素的电离能数据如下 (kJ·mol-1):
I1
I2
I3
I4
…
496
4562
6912
9540
…
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键
F—D
F—F
B—B
F—B
C—D
D—D
键能/kJ·mol-1
460
176
347.7
347
745
497.3
试计算1 mol F单质晶体燃烧时的反应热ΔH=_____________(要写单位)。
高二化学填空题简单题查看答案及解析
-
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种常见无水盐的化学式_____________。
⑵下图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示__________。E与D按原子个数比1﹕1形成的化合物的电子式为_____________________。

⑶人们通常把拆开l mol某化学键所吸收的能量看成该
化学键的键能。键能的大小可以衡量化学键的强弱,也可以
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和
的差。下表列出了上述部分元素形成的化学键的键能:
化学键
F—D
F—F
B—B
F—B
C═D
D═D
键能/kJ·mol-1
460
176
347.7
347
745
497.3
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):_________。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②试估算F单质晶体的燃烧热:____________________________________。
高二化学填空题简单题查看答案及解析
-
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如下 (kJ•mol-1):
I1
I2
I3
I4
…
496
4562
6912
9540
…
(1)写出只含有A、B、D、E四种元素的一种无水盐的化学式____________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)BD2分子中B原子的杂化方式是____________。
(4)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
化学键
F-D
F-F
D=D
键能/kJ•mol-1
460
176
497.3
试计算1mol F单质晶体燃烧时的反应热△H=______。(已知1molF单质中含2mol F-F键,1mol FO2中含有4mol F-O键)
高二化学推断题中等难度题查看答案及解析
-
(7分)有A、B、C、D、E、F六种元素。已知:
①它们位于三个不同的短周期,核电荷数依次增大。
②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
I1
I2
I3
I4
…
496
4562
6912
9540
…
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________、________。
(2)B2A4分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键
A—A
C—C
A—C
键能/kJ·mol-1
436
946
390.8
试计算A单质与C单质反应生成CA3时的反应热ΔH=_____ (要写单位)。
高二化学填空题中等难度题查看答案及解析
-
有A、B、C、D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大 ②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如下 :I1 I2 I3 I4 … 496 4562 6912 9540 …
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________、________.
(2)B2A2分子中存在________个σ键,________个π键.
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
试计算1mol F单质晶体燃烧时的反应热△H=________(要写单位).化学键 F-D F-F B-B F-B C-D D-D 键能/kJ•mol-1 460 176 347.7 347 745 497.3 高二化学填空题中等难度题查看答案及解析
-
(10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:

(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示________, E与D按原子个数比1﹕1形成的化合物的电子式为________。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
化学键
F—D
F—F
B—B
F—B
C═D
D═D
键能/kJ·mol-1
460
176
347.7
347
745
497.3
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):________
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) 加热 FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为:________。
高二化学填空题极难题查看答案及解析
-
有A,B,C,D、E、F六种元素,已知:
①它们位于三个不同短周期,核电荷数依次增大。
②E元素的电离能数据见下表(kJ·mol-1):
③B与F同主族。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤B,C分别都能与D按原子个数比1∶1或1∶2形成化合物。
(1)写出只含有A,B、D、E四种元素的两种无水盐的化学式__________、__________。
(2)B2A2分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:

试计算1 mol F单质晶体燃烧时的反应热ΔH______(要写单位)。
高二化学综合题中等难度题查看答案及解析
-
Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素
相关信息
Y
原子核外有6个不同运动状态的电子
Z
非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同
W
主族元素,与Z原子的价电子数相同
R
价层电子排布式为3d64s2
M
ⅠB族,其单质常用作导线
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。

高二化学推断题中等难度题查看答案及解析
-
已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E 。
(2)C元素的价电子排布图为: ;
该排布遵循的原理主要有: (答完整得分)。
(3)C、D元素形成的化合物主要有: (填化学式,答完整得分);其中相对分子质量较小的分子为 分子(填“极性”或“非极性”),该分子的空间构型为 ,中心原子的杂化方式是 。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为 ;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于 形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
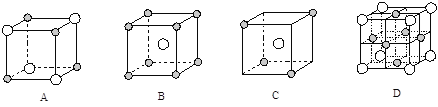
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中
和
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
高二化学填空题困难题查看答案及解析