-
秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾羅的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_____________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
向一定条件下的恒容密用容器中充入NO和CO,用传感器测得该反应在不同时间时NO和CO的浓度如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| c(CO)/mol/L | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(NO)=V(CO)
②此条件下达到平衡时,该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下, NaHSO3显___性 (填“酸”“碱”或“中”,判断的理由是(通过计算说明)______。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。
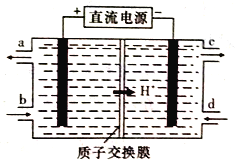
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
-
秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·mol−1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·mol−1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g) N2(g)+2CO2(g)ΔH<0
N2(g)+2CO2(g)ΔH<0
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
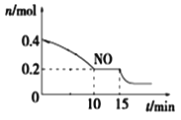
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
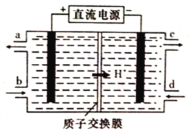
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:_______________________________。
-
秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g) N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。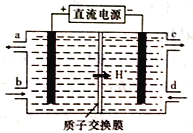
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
-
冬季是雾霾大气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(l)工业上利用甲烷催化还原NOx可减少氮氧化物的排放。已知:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________。
(2)将CO2转化为甲醇可以实现废物利用,达到节能减排的目的,反应原理可表示为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。请回答:
0~3min内氢气的平均反应速率为______mol/(L·min);
第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和3molH2 (g),则达到平衡时CH3OH的体积分数_________(填“增大”、“减小”或“不变”)。

②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3___0(填“>”、“<”或“=”)。
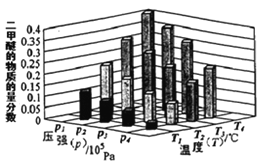
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率σ随温度、投料比 的变化曲线如图3所示。
的变化曲线如图3所示。
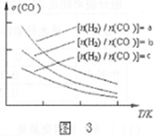
①a、b、c按从大到小的顺序排序为___________。
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______。
A.逆反应速率先增大后减小 B.混合气体的密度增大
C.化学平衡常数K值减小 D.氢气的转化率减小
-
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4 和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g) 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) ⇌CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____。
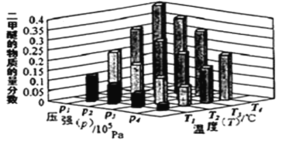
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g)⇌ SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K= ______。
(5)利用原电池反应可实现NO2 的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH ____(填“变大”、“变小”或“不变”),负极电极反应式为 ____。
-
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol ,则CH4(g) + O2(g) = CH3OH(g) △H=___。
O2(g) = CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g) + 4H2(g)  CH3OCH3(g) + H2O(g) △H<0。
CH3OCH3(g) + H2O(g) △H<0。
①.某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中 CH3OCH3(g) 的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是___。
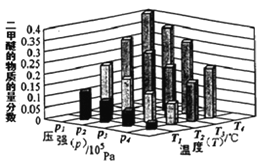
A. P1>P3, T1>T3 B. P3>P2,T3>T2 C.P2>P4,T4>T2 D.P1>P4,T2>T3
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.某反应物的体积百分含量增大
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2, 发生反应CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。
CH3OH(g),CO的平衡转化率[与温度(T)、压强(p)的关系如图所示。
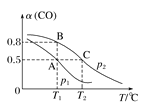
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
-
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)⇌CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____。
A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__(填编号)
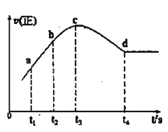
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
-
汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol−1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH =-1160kJ·mol−1
甲烷直接将NO2还原为N2的热化学方程式为____________________________。
(2)减少汽车尾气污染的原理为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
N2(g)+2CO2(g) ΔH <0。向恒温恒容密闭容器中充入NO和CO,用传感器测得的数据如下表所示:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/×10-3mol·L−1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
| c(CO)/×10-3mol·L−1 | 9.00 | 4.00 | 2.00 | 1.00 | 1.00 |
①为了提高尾气处理的效果,可采取的措施有____________(写出两种即可)。
②此条件下达到平衡时,计算该反应的平衡常数K=____________________。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是________溶液。
②常温下,NaHSO3显_________性(填“酸”“碱”或“中”),判断的理由是________________________________________________(通过计算说明)。
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的__________(填字母代号)口流出。
②写出阴极的电极反应式______________________。
-
冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①一定条件下,在一个容积固定为2L的密闭容器中充入0.8mol NO和1.2mol CO,开始反应至2min时测得CO转化率为20%,则用N2表示的平均反应速率为v(N2)=_________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应平衡常数的表达式KP=_________。
③该反应在低温下能自发进行,该反应的△H_________0(填“>”、“<”)
④在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是_________(填编号)
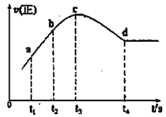
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2>t2~t3
(2)使用甲醇汽油可以减少汽车尾气对环境的污染.某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g) CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通入3mol CO,此时v(正)_________v(逆)(填“>”、“<”或“=”),判断的理由_________。
(3)二甲醚也是清洁能源.用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:
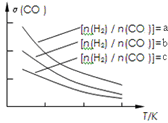
①a、b、c按从大到小的顺序排序为_________。
②某温度下,将某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3所示,关于温度和压强的关系判断正确的是_________
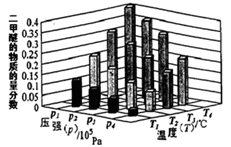
A.P3>P2,T3>T2B.P1>P3,T1>T3
C.P2>P4,T4>T2D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_________
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小.
-
(15分)冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为V(N2)=____________________。
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。
③该反应在低温下能自发进行,该反应的△H_________0,(选填“>”、“=”或“<”)
④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知t2—t1=t3—t2)。
则下列说法不正确的是__________。(填编号)
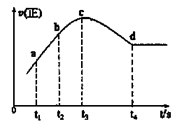
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率t1—t2=t2—t3
(2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)⇌CH3OH(g),到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通人3mol CO,此时v(正)__________ v(逆)(选填‘‘>”、“<’’或“=”),判断的理由__________________。
(3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比 的变化曲线如图:
的变化曲线如图:
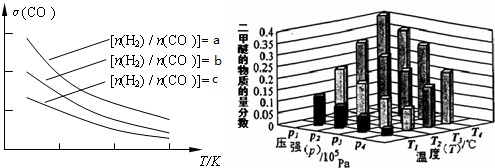
①a、b、c按从大到小的顺序排序为___________。
②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是___________;
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________:
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积百分含量增大
E.混合气体的密度减小
F.氢气的转化率减小
N2(g)+2CO2(g) △H<0
















